6 minutes de lecture
Étude GMR2 : résultats de la phase III d’une étude évaluation l’efficacité et la sureté d’une trithérapie en mono-prise
Publié le mardi 3 septembre 2024
En direct du congrès de l'ESC 2024
D’après “Novel low-dose triple single-pill combination shows efficacy and tolerability in two international trials (GMRx2)”
Messages clés
Un comprimé contenant de faibles doses d’amlodipine, indapamide et telmisartan a démontré des réductions significatives de la pression artérielle systolique (vs bithérapie ou placebo), atteignant chez 70 % des patients un contrôle tensionnel en 12 semaines (1). Bien tolérée, cette combinaison pourrait améliorer l’observance et diminuer l’inertie en HTA.
Introduction
À l'échelle mondiale, la majorité des patients traités pour une HTA n'atteignent pas un contrôle optimal, principalement en raison de la persistance de l'utilisation de traitements peu efficaces, notamment la monothérapie.
Les recommandations actuelles préconisent l'initiation du traitement antihypertenseur par une bithérapie en mono-prise. La mise en place d'une trithérapie intervient généralement plus tard dans le parcours de soins, lorsque la pression artérielle (PA) demeure non contrôlée.
Certaines études ont démontré que l'initiation d'un traitement antihypertenseur par une trithérapie, voire une quadrithérapie, à faible dose et mono-prise, est plus efficace pour contrôler la PA tout en présentant un bon profil de tolérance. Les combinaisons médicamenteuses à faible dose, sous forme mono-prise, offrent une perspective prometteuse pour améliorer la prise en charge de l'HTA, grâce aux effets additifs des molécules, à une action rapide, et à un faible risque d'effets indésirables. À ce jour, aucune trithérapie en prise unique faiblement dosée n'est disponible sur le marché.
Cette étude de phase III (GMRx2) vise à évaluer l’efficacité et la tolérance d’une telle trithérapie.
Méthodologie et résultats
GMRx2 contient du telmisartan, de l'amlodipine et de l'indapamide, disponibles en trois dosages : quart-dose (10 mg, 1,25 mg et 0,625 mg respectivement), demi-dose (20 mg, 2,5 mg et 1,25 mg), et pleine dose (40 mg, 5 mg et 2,5 mg).
Cette étude avait pour objectif de comparer l'efficacité et la sécurité d'une trithérapie en prise unique (GMRx2) par rapport à un placebo, ainsi que d'évaluer l'apport individuel de chaque molécule de l'association GMRx2 en comparant les différentes associations sous forme de bithérapie.
Étude d'efficacité et de sécurité du GMRx2
L'évaluation de l'efficacité et de la sécurité de cette trithérapie a été réalisée dans le cadre d'un essai international, contrôlé, randomisé en double aveugle, avec comparaison versus placebo.
Les critères d'inclusion comprenaient l'absence de traitement antihypertenseur ou la prise d'une monothérapie antihypertensive, un diagnostic probable d'HTA, un faible risque cardiovasculaire, et l'absence de contre-indications à la prise du placebo ou du GMRx2.
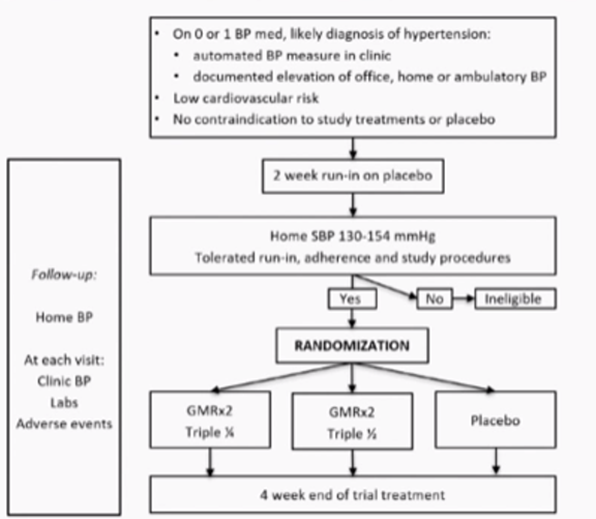
Après une période de washout de 2 semaines, durant laquelle tout traitement antihypertenseur était interrompu, les patients présentant une pression artérielle systolique (PAS) au domicile entre 130 et 154 mmHg et une bonne adhérence au traitement ont été éligibles pour une randomisation selon un ratio 2:2:1 pour recevoir soit GMRx2 à quart-dose, GMRx2 à demi-dose, soit un placebo (Figure 1).
Figure 1 : design de l’étude
Le critère principal d'efficacité était la variation moyenne de la PAS en mesure clinique au domicile entre le début de l'étude et la semaine 4, tandis que le critère principal de sécurité était l'interruption du traitement en raison d'effets indésirables.
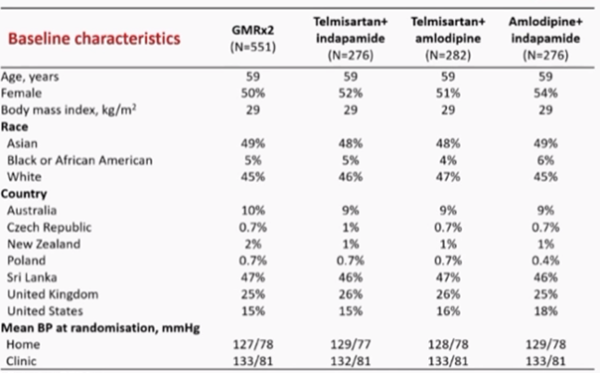
Sur les 1584 patients initialement évalués, 295 ont été randomisés dans l'étude. Peu de patients ont été perdus de vue. Les caractéristiques à l’inclusion sont présentées dans le Tableau 1.
Tableau 1 : caractéristiques à l’inclusion
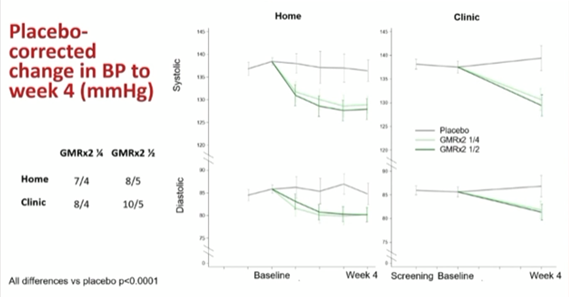
La PA moyenne mesurée en consultation était de 138/86 mmHg après la période de washout de 2 semaines. À la semaine 4, la réduction corrigée par rapport au placebo de la PAS à domicile était de -7,3 mmHg avec la quart-dose de GMRx2 et de -8,2 mmHg avec la demi-dose de GMRx2 (p<0,001 pour les deux doses par rapport au placebo, (Figure 2).
Figure 2 : différence de la pression artérielle diastolique et systolique entre l’inclusion et la semaine 4
Des résultats similaires ont été observés pour la PAS mesurée en cabinet : une baisse de 8 mmHg avec la quart-dose de GMRx2 et de 10 mmHg avec la demi-dose (p<0,001 pour les deux doses par rapport au placebo). Une réduction de la PA diastolique (PAD) en mesure clinique au domicile a également été observée.
Il n'a été noté aucune différence d'efficacité dans les analyses en sous-groupes.
Un contrôle de la PA (défini comme une PA <140/90 mmHg) a été obtenu chez 37 % des participants sous placebo, contre 65 % et 70 % des participants dans les groupes GMRx2 à quart- et demi-dose respectivement (p<0,001 pour les deux doses vs. placebo).
L'interruption du traitement en raison d'effets indésirables a concerné 1,6 % des participants du groupe placebo et 0 % et 5,1 % des participants des groupes GMRx2 à quart- et demi-dose respectivement. Les effets indésirables les plus fréquents incluaient des anomalies biologiques mineurs et des symptômes d'hypotension.
Évaluation de la contribution de chaque molécule à la trithérapie
Cette étude a également comparé le GMRx2 demi-dose à une bithérapie (telmisartan/amlodipine, telmisartan/indapamide, et amlodipine/indapamide, voir Figure 3).
Des résultats similaires ont été observés pour la PAS mesurée en cabinet : une baisse de 8 mmHg avec la quart-dose de GMRx2 et de 10 mmHg avec la demi-dose (p<0,001 pour les deux doses par rapport au placebo). Une réduction de la PA diastolique (PAD) en mesure clinique au domicile a également été observée.
Il n'a été noté aucune différence d'efficacité dans les analyses en sous-groupes.
Un contrôle de la PA (défini comme une PA <140/90 mmHg) a été obtenu chez 37 % des participants sous placebo, contre 65 % et 70 % des participants dans les groupes GMRx2 à quart- et demi-dose respectivement (p<0,001 pour les deux doses vs. placebo).
L'interruption du traitement en raison d'effets indésirables a concerné 1,6 % des participants du groupe placebo et 0 % et 5,1 % des participants des groupes GMRx2 à quart- et demi-dose respectivement. Les effets indésirables les plus fréquents incluaient des anomalies biologiques mineurs et des symptômes d'hypotension.
Évaluation de la contribution de chaque molécule à la trithérapie
Cette étude a également comparé le GMRx2 demi-dose à une bithérapie (telmisartan/amlodipine, telmisartan/indapamide, et amlodipine/indapamide, (Figure 3).
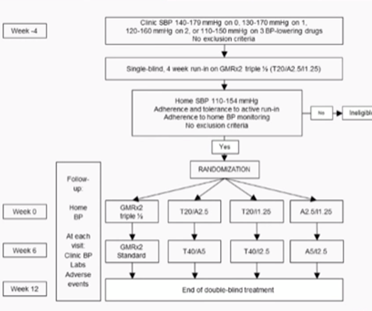
Figure 3 : design de l’étude évoluant GMRx2 versus un bithérapie de chacune de ses molécules
Le critère de jugement principal était la PAS en mesure clinique au domicile à 12 semaines.
L'essai a recruté 1385 adultes sous 0 à 3 traitements antihypertenseurs, avec une PAS comprise entre 140 et 179 mmHg (sans traitement) et entre 110 et 150 mmHg (sous trois traitements). Les caractéristiques de la population sont résumées dans le Tableau 2.
Tableau 2 : caractéristiques de la population de comparaison d’une trithérapie versus bithérapie
Pendant une période de run-in de 4 semaines, les traitements existants ont été remplacés par GMRx2 à demi-dose. Les patients ayant une PAS entre 110 et 154 mmHg à 4 semaines, avec une bonne adhérence et tolérance au traitement, ont ensuite été randomisés selon un ratio 2:1:1:1 pour recevoir soit une demi-dose de GMRx2, soit l'une des trois combinaisons duales possibles à demi-dose (telmisartan 20 mg/amlodipine 2,5 mg, telmisartan 20 mg/indapamide 1,25 mg ou amlodipine 2,5 mg/indapamide 1,25 mg). À la semaine 6, les doses ont été doublées dans tous les groupes, sauf en cas de contre-indication clinique.
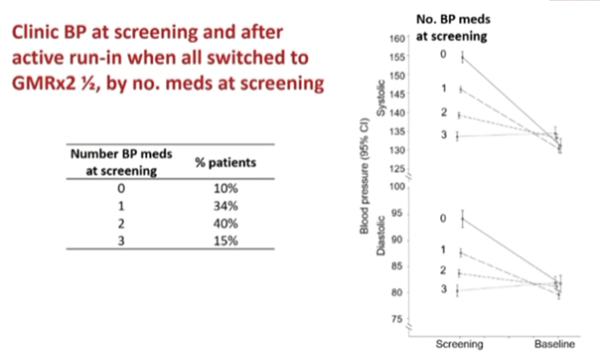
La Figure 4 montre la différence de pression artérielle entre le screening initial et après la période de run-in de 4 semaines. Les patients ayant moins de traitements antihypertenseurs lors du screening ont présenté une baisse plus marquée de la PAS et de la PAS après la PAD de run-in.
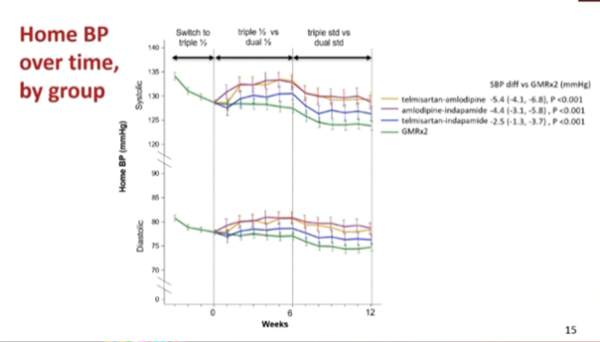
Une réduction de la pression artérielle systolique et diastolique a été observée pendant la période de run-in, suivie d'une ré-ascension chez les patients sous bithérapie à la fin de cette période. À la semaine 12, la PA au domicile était plus basse avec GMRx2 qu'avec chacune des combinaisons duales : les réductions par rapport aux groupes telmisartan/indapamide, telmisartan/amlodipine, et amlodipine/indapamide étaient de 2,5/2,1, 5,4/3,4 et 4,4/3,6 mmHg respectivement (toutes p<0,0001, (Figure 5).
Figure 4 : différence de pression artérielle entre l’inclusion et la période de run-n
Figure 5 : critère de jugement principal – changement de la pression artérielle au domicile à 12 semaines
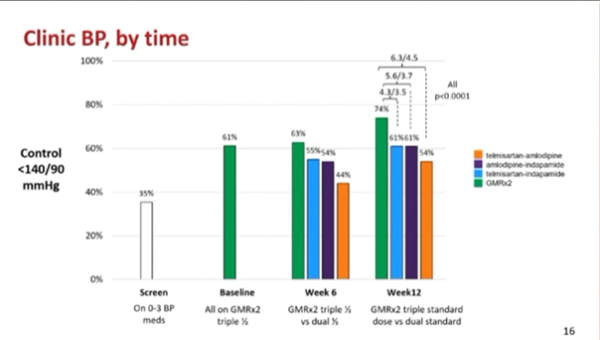
La proportion de participants avec une PA clinique <140/90 mmHg à la semaine 12 en mesure au cabinet était de 74 % avec GMRx2, 61 % avec telmisartan/indapamide et telmisartan/amlodipine, et 53 % avec amlodipine/indapamide (comparaisons vs. GMRx2 : toutes p≤0,0001). Seulement 35 % des patients avaient leur PA contrôlée au moment du screening. Au moment du run-in, 61 % avaient une PA contrôlée. Après le passage à la bithérapie, une baisse du contrôle tensionnel de 10 à 20 % a été observée à 6 semaines (Figure 6).
Figure 6 : pourcentage de patients avec une PA contrôlée
Il n'a pas été noté de différence dans les analyses en sous-groupes.
L'interruption du traitement en raison d'effets indésirables a concerné 2,0 % des participants sous GMRx2 et 1,4 %, 1,1 % et 1,4 % des groupes telmisartan/indapamide, telmisartan/amlodipine, et amlodipine/indapamide respectivement. Cette différence n’était pas statistiquement significative.
Conclusion
GMRx2 réduit rapidement la PA chez les patients présentant une HTA légère à modérée, et ce, de manière plus efficace qu’un placebo ou une bithérapie, dans une large population d’hypertendus, sans augmentation des effets indésirables.
La disponibilité de cette combinaison sous forme de comprimé unique pourrait contribuer à réduire l'inertie thérapeutique actuelle, permettant aux patients d'atteindre un contrôle optimal de la PA en quelques étapes, avec des bénéfices potentiels pour améliorer l'adhérence au traitement.
Références
1. Rodgers A, Salam A, Schutte AE, Cushman WC, de Silva HA, Di Tanna GL, et al. Efficacy and Safety of a Novel Low-Dose Triple Single-Pill Combination Compared With Placebo for Initial Treatment of Hypertension. J Am Coll Cardiol. 31 août 2024
Dans la même thématique
Articles les plus lus

Études BedMed & BedMed Frail : à quel moment prendre son traitement antihypertenseur ?
Publié le 31 août 2024
L’essai SENIOR-RITA : quelle prise en charge du NSTEMI chez le patient âgé ?
Publié le mardi 3 septembre 2024
Étude ABYSS : interrompre ou poursuivre les bétabloquants après un infarctus du myocarde non compliqué ?
Publié le samedi 31 août 2024
Etude QUADRO : résultats de l’étude phase III évaluant une quadrithérapie antihypertensive en monoprise dans l’HTA résistante
Publié le lundi 2 septembre 2024
FINE-HEART : impact bénéfique de la finérénone sur les maladies cardiovasculaires, rénales et métaboliques.
Publié le lundi 2 septembre 2024