2 minutes de lecture
Intérêt du vutrisiran dans le traitement de la cardiomyopathie amyloïde à transthyrétine : résultats de l’étude HELIOS-B à 3,5 ans de suivi
Publié le mardi 27 mai 2025
En direct du congrès de l'HFA 2025
D’après « HELIOS-B : Suivi prolongé de l’utilisation de Vutrisiran dans la cardiomyopathie ATTR »
Messages clés
En prenant en compte les données additionnelles de mai 2024 à novembre 2024, l’effet bénéfique de vutrisiran demeure constant dans la réduction de la mortalité toutes causes et des évènements cardiovasculaires, utilisé en monothérapie ou en bithérapie associée au tafamidis.
Introduction
La cardiomyopathie amyloïde à transthyrétine (ATTR-CM) est une pathologie affectant la structure et la fonction du myocarde, menant à l’insuffisance cardiaque et au décès. La physiopathologie repose sur le dépôt de fibrilles amyloïdes de TTR dans le myocarde. Les traitements spécifiques actuellement approuvés comprennent uniquement des stabilisateurs de la TTR, tels que le Tafamidis.
Le vutrisiran, un modulateur d’ARN à administration sous-cutanée tous les 3 mois, réduit la production hépatique de transthyrétine. L’essai randomisé HELIOS-B, mené chez 655 patients et publié initialement en août 2024, a démontré que le vutrisiran, entraîne une diminution significative de la mortalité toutes causes et des événements liés à l’insuffisance cardiaque chez les patients porteurs d’une cardiomyopathie ATTR. Ces résultats ont été observés tant chez les patients recevant le Vutrisiran en monothérapie (60% des patients dans chaque bras) qu’en association avec le tafamidis (40% des patients dans chaque bras).
L’analyse initiale des données s’arrêtait à mai 2024 (36 mois post-randomisation). La présente mise à jour prend en compte six mois supplémentaires de données, jusqu’en novembre 2024.
Méthodologie et résultats
Méthode
HELIOS-B avait inclus des patients ATTR, très majoritairement en classe 2 de la NYHA. La durée totale de suivi de HELIOS-B a été désormais portée à 42 mois post-randomisation. À ce stade, 96,4 % des patients initialement inclus étaient toujours suivis.
Résultats
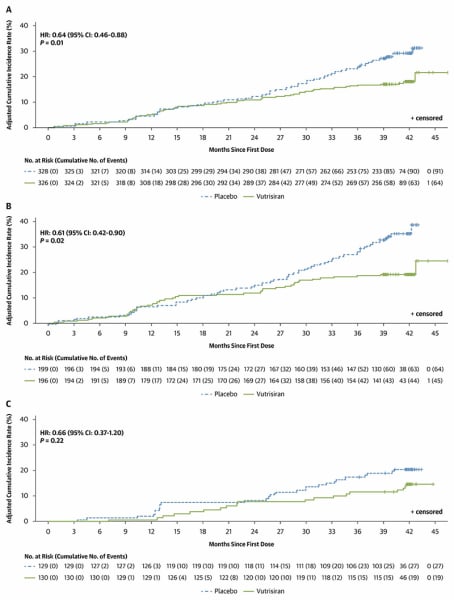
Les résultats retrouvent une diminution de 36% du risque de mortalité toutes causes (P=0.01) et de 33% du risque de mortalité cardiovasculaire (P=0.04) dans le bras vutrisiran par rapport au bras contrôle. À noter une réduction significative des hospitalisations pour cause cardiovasculaire et des hospitalisations pour insuffisance cardiaque dans le bras vutrisiran par rapport au bras contrôle. Pour tous les critères de jugement susmentionnés, les courbes continuent à s’écarter au cours du suivi, soulignant l’intérêt du traitement par vutrisiran dans la durée.
Le suivi de l’étude est prévu jusqu’à 60 mois post-randomisation.
Figure 1 : Mortalité toute causes dans l’ensemble de la population (A), dans le groupe monothérapie par vutrisiran (B) et dans le groupe vutrisiran + tafamidis (C)
Conclusion
L’effet du vutrisiran dans la réduction de la mortalité toutes causes et de la morbi-mortalité cardiovasculaire se confirme après un suivi de 3,5 ans. Ces données renforcent le rôle potentiel de vutrisiran dans la prise en charge de la cardiomyopathie ATTR.
Références
1. Fontana M, Berk JL, Gillmore JD, et al. "Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy." The New England Journal of Medicine. 2024;391(9):813–823. doi:10.1056/NEJMoa2409134.
2. Witteles et al., JACC. 2025 May, 85 (20) 1959–1970
Dans la même thématique
Articles les plus lus

Dépistage de l’insuffisance cardiaque à l’aide du questionnaire EPOF et du dosage capillaire des NT-proBNP
Publié le vendredi 23 mai 2025
Nex-Z : une révolution génique contre l’amylose cardiaque à transthyrétine
Publié le vendredi 23 mai 2025
Fonction rénale et hospitalisation pour insuffisance cardiaque : une alerte précoce chez les patients à FEVG réduite
Publié le vendredi 23 mai 2025
Étude PRAISE-HFrEF : sécurité des agonistes GLP-1 chez les patients atteints d’insuffisance cardiaque à fraction d’éjection réduite
Publié le vendredi 23 mai 2025