6 minutes de lecture
OCTIVUS : revascularisation coronaire par angioplastie guidée par OCT vs IVUS
Publié le lundi 28 août 2023
Auteur :
Louis Perrard
Membre du Collège des Cardiologues en Formation,
Amiens
Relecteur :
Antonin Trimaille
Membre du Collège des Cardiologues en Formation,
Strasbourg
En direct de l'ESC Congress 2023
D'après la présentation de Duk-Woo Parl (Séoul, Corée-du-Sud) : "OCTIVUS: OCT- vs. IVUS-Guided PCI"
Les messages clés
- La revascularisation coronaire par angioplastie guidée par imagerie endo-coronaire (IVUS ou OCT) a montré sa supériorité sur la revascularisation guidée par angiographie seule
- L’objectif de cette étude était de comparer l’efficacité clinique et la sécurité de la revascularisation coronaire guidée par OCT et par IVUS
- À 1 an, la revascularisation coronaire guidée par OCT n’est pas inférieure à la revascularisation guidée par IVUS sur un critère composite de la mortalité cardiovasculaire, infarctus du myocarde lié à la lésion initiale, et revascularisation de la lésion initiale
Introduction
La revascularisation coronaire par angioplastie (PCI) guidée par l’imagerie endocoronaire a montré une supériorité clinique sur la revascularisation guidée par angiographie seule1-4. Les recommandations actuelles, américaines et européennes, préconisent l’utilisation de l’imagerie endocoronaire en grade IIA comme une aide pour guider l’angioplastie chez des patients sélectionnés.
Les deux modalités d’imagerie endocoronaire sont l’échographie (IVUS) et la tomographie par cohérence optique (OCT), avec une caractérisation des lésions différente et ainsi des avantages, des inconvénients et une utilisation différentes5. Il y a peu de données dans la littérature comparant l’efficacité de ces deux techniques pour le guidage d’une angioplastie6-7.
L’objectif de cette étude était de comparer l’efficacité clinique et la sécurité de la revascularisation coronaire guidée par OCT et par IVUS.
Principe de l'étude, méthodologie et résultats
Il s’agit d’une étude sud-coréenne, multicentrique (9 centres), prospective, randomisée (par blocs de permutation de 4 ou 6, stratifiés sur le centre), ayant inclus des patients souffrant d’une maladie coronaire obstructive, adressés pour PCI en routine clinique, randomisés dans le groupe expérimental (OCT) ou dans le groupe témoin (IVUS).
Les critères d’exclusion étaient un STEMI, une insuffisance rénale sévère (DFG < 30 mL/min), une dysfonction ventriculaire gauche sévère définie par une FEVG < 30 %, une espérance de vie < 1 an, et l’impossibilité de l’utilisation de l’imagerie endocoronaire.
Dans les 2 groupes, l’OCT ou l’IVUS étaient utilisées avant, pendant et immédiatement après stenting. Il était recommandé de réaliser une nouvelle acquisition après optimisation thérapeutique. Le choix de la taille du stent, sa longueur et la décision de procéder à une optimisation thérapeutique par post-dilatation étaient décidés selon un algorithme prédéfini, commun aux 2 groupes, et basé sur un consensus d’experts.
Le résultat final était jugé satisfaisant lorsque le stent était expandu à plus de 80 % du diamètre de référence, sans malapposition ni dissection de bord. Les données d’imagerie endocoronaire étaient analysées par un corelab indépendant.
Le critère de jugement principal consistait en l’échec du traitement de la lésion cible à 1 an, défini par le composite de la mortalité cardiovasculaire, infarctus du myocarde lié à la lésion initiale, et revascularisation de la lésion initiale.
Les critères de jugement secondaires comportaient les éléments du critère de jugement principal pris individuellement, la thrombose de stent, le taux d’accident vasculaire cérébral (AVC), de nouvelle revascularisation ou hospitalisation, les saignements, l’insuffisance rénale aiguë induite par l’injection de produit de contraste, et les complications péri-procédurales nécessitant une intervention active.
Au total, 2 008 patients ont été inclus dans l’étude : 1 005 dans le groupe OCT et 1 003 dans le groupe IVUS. Il s’agissait d’une population coronarienne « classique », composée principalement d’hommes (79 %), âgés de 65 ans en moyenne, 30 % étaient diabétiques, > 60 % hypertendus, > 80 % dyslipidémiques, 20 % tabagiques actifs, porteurs d’une FEVG préservée (58 % en moyenne) et adressés pour syndrome coronaire chronique (> 65 %).
Plus de 60 % des patients présentaient des lésions pluritronculaires, entre 10 et 15 % des lésions du tronc commun, > 50 % une absence de lésion de bifurcation mais des lésions diffuses et longues (lésions ≥ 28 mm ou stent ≥ 32 mm). Les patients étaient globalement à bas risque (score SYNTAX moyen de 15 %).
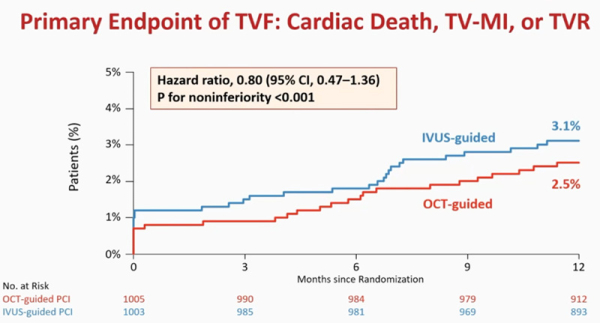
L’analyse statistique du critère de jugement principal a retrouvé 2,5 % d’évènements dans le groupe OCT vs 3,1 % dans le groupe IVUS, soit une non-infériorité de l’OCT versus l’IVUS (HR 0,80, IC 95 % 0,47-1,36, p < 0,001) (Figure 1).
Figure 1 : Courbes de Kaplan Meier du critère de jugement principal (composite de la mortalité cardiovasculaire, infarctus du myocarde attribuable au vaisseau cible, ischémie résiduelle du vaisseau cible nécessitant une revascularisation complémentaire) dans les deux groupes
L’analyse statistique des critères de jugement secondaires retrouve une absence de différence significative entre les groupes sur l’ensemble des critères.
Une analyse de sensibilité a été réalisée en per-protocole avec des résultats similaires. Une analyse en sous-groupes a été réalisée selon l’âge (< ou ≥ 65 ans), le sexe (féminin ou masculin), la présence d’un diabète (oui/non), la présence d’un syndrome coronarien aigu (SCA, oui/non) et la FEVG (< ou ≥ 50 %) : aucune différence significative n’a été observée entre les deux groupes.
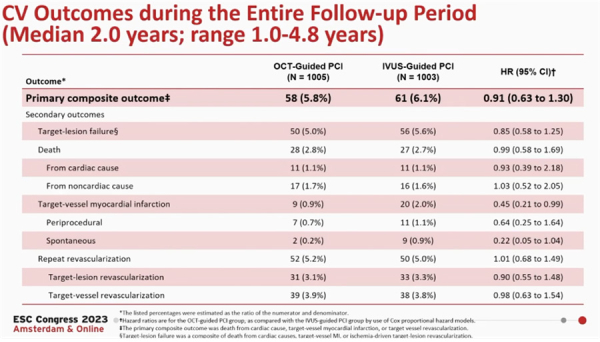
Une extension de l’analyse statistique sur l’ensemble de la période de suivi (suivi médian de 2 ans) retrouve des résultats similaires (Figure 2).
Figure 2 : Analyse des critères de jugement principal et secondaires après un suivi médian de 2 ans
Un volume de produit de contraste plus important a été observé dans le groupe OCT, en comparaison avec le groupe IVUS (238,3 ± 112,4 mL vs 199,8 ± 109,7 mL respectivement, p < 0,001) sans impact sur la fonction rénale. On observe également dans le groupe IVUS un taux de succès procédural plus important (54,9 % vs 48,3 % dans le groupe OCT, p < 0,003), un temps d’intervention plus long (48,9 ± 25,1 min vs 46,1 ± 23,6 min pour l’OCT, p < 0,001) et un taux de complications périprocédurales plus important (3,7 % vs 2,2 %, p = 0,047) bien qu’aucune n’ait été reliée à l’imagerie endocoronaire.
L’analyse par un corelab indépendant d’imagerie endocoronaire retrouve une tendance en faveur de l’IVUS, avec une surface minimale du stent (MSA) plus importante (6,70 ± 2,37 mm² vs 5,60 ± 2,01 mm² pour l’OCT, p < 0,.001), une expansion minimale du stent plus élevée (91,37 ± 22,31 % vs 85,36 ± 17,49 %, p < 0,001) et une meilleure optimisation du stent (60,1 % vs 53,4 %, p = 0,001) retrouvée dans tous les types (expansion optimale du stent, plaque < 50 % en entrée de stent, malapposition majeure, large dissection).
Conclusion
Chez les patients atteints d’une maladie coronaire obstructive adressés pour angioplastie, la revascularisation coronaire guidée par OCT n’est pas inférieure à la revascularisation coronaire guidée par IVUS à 1 an sur un critère composite de la mortalité cardiovasculaire, infarctus du myocarde lié à la lésion initiale, et revascularisation de la lésion initiale.
Pour aller plus loin
Malgré un bon suivi, avec moins de 1 % de perdus de vue, cette étude présente certaines limites, comme l’absence d’aveugle sur le dispositif d’imagerie endocoronaire, un nombre d’évènements plus faible qu’attendu (possiblement expliqué par les difficultés de recrutement durant la pandémie liée au COVID-19, une population de patients à bas risque et une amélioration des thérapeutiques récentes), une validité externe incertaine (étude sud-coréenne) et l’absence d’inclusion d’un bras guidée par l’angiographie seule.
Les résultats de cette étude sont néanmoins susceptibles d’impacter nos pratiques, du fait de l’utilisation d’un critère de jugement principal clinique (par opposition à d’autres études ayant choisi des critères d’imagerie), une approche pragmatique (algorithme commun aux deux techniques d’imagerie endocoronaire) et de vie-réelle (peu de critères d’exclusions).
L’utilisation en pratique courante de l’OCT et de l’IVUS dépend actuellement de leur disponibilité, de leur coût et des habitudes de chaque centre. Du fait de leurs caractéristiques techniques différentes, elles apparaissent complémentaires, et il paraît donc intéressant de se former aux deux techniques. Cette étude confirme d’ailleurs des avantages et inconvénients pour chaque technique (plus de produit de contraste pour l’OCT, temps de procédure plus long pour l’IVUS).
De futures études seront nécessaires pour préciser quels patients et quelles lésions bénéficieront le plus de chacune des techniques.
Références bibliographiques
- Hong SJ, et al, JAMA 2015.
- Kim BK, et al, Circ Cardioasc Interv, 2015
- Zhang J, et al, JACC 2018
- Lee JM, et al, NEJM, 2023
- Schlofmitz E et al, Circ Cardioasc Interv, 2020
- Ali ZA, et al, LANCET 2016
- Kubo T, et al, EHJ, 2017
Pour en savoir plus, consultez les LBS, LBT et hotlines complètes, en langue anglaise, présentées lors de l'ESC 2023 :
Toute l'actualité de l'ESC 2023
Cette couverture de congrès vous est proposée grâce au soutien institutionnel de
l'alliance Boehringer Ingelheim - Lilly, de CSL Vifor et de Sanofi
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio-online ou de la SFC, et n'engage pas leur responsabilité.
|
Dans la même thématique
Articles les plus lus
OCT vs. IVUS - L’imagerie endo-coronaire améliore le pronostic comparé à l’angiographie simple dans les angioplasties coronaires complexes
Publié le lundi 28 août 2023
ECLS-SHOCK - L’assistance circulatoire par ECLS dans l’infarctus du myocarde compliqué de choc cardiogénique : échec et mat ?
Publié le mardi 29 août 2023
Etude CAMAREC : intérêt de l'IRM cardiaque pour identifier l’étiologie coronaire dans l'insuffisance cardiaque à FEVG réduite
Publié le mercredi 30 août 2023