3 minutes de lecture
La thérapie génique dans l’insuffisance cardiaque à FEVG réduite : premiers pas prometteurs
Publié le mardi 27 mai 2025
En direct du congrès de l'HFA 2025
D’après “NAN-CS101: A first-in-human Phase 1 open-label dose-escalation study of AB-1002 gene therapy for the treatment of NYHA class III heart failure”
Messages clés
- La thérapie génique AB-1002 (NAN-101), administrée par infusion intracoronaire, est bien tolérée et montre des signes d'amélioration clinique chez les patients atteints d'insuffisance cardiaque non ischémique de classe NYHA III avec FEVG réduite
- Les premiers résultats suggèrent une amélioration de la FEVG, de la classe NYHA, de la qualité de vie et des performances à l’effort, sans événements indésirables graves liés à la thérapie
- Ces données soutiennent la poursuite du développement de cette approche innovante ciblant les voies moléculaires de la contractilité cardiaque
Introduction
AB-1002 (NAN-101) est une thérapie génique en développement pour le traitement de l’insuffisance cardiaque à fraction d’éjection sévèrement réduite des patients atteints d’une cardiomyopathie non-ischémique restant symptomatiques (NYHA III). Cette thérapie génique utilise comme vecteur une capside adénoviral cardiotrope (AAV2/6.8). Celle-ci contient un promoteur universel et le transgène. Celui-ci exprime la protéine I-1c – constitutionnellement active- dont l’action est de bloquer l’activité de la protéine phosphatase 1 (PP1), restaurant ainsi le cycle du calcium, le couplage excitation-contraction au niveau des cardiomyocytes et améliorant ainsi potentiellement la contractilité myocardique.
Initialement explorée dans la dystrophie musculaire de Duchenne, elle est aujourd’hui évaluée dans l’insuffisance cardiaque non ischémique avec FEVG réduite, dans l’étude de phase 1 NAN-CS101.
Méthodologie et résultats
Population
Patients adultes atteints de cardiomyopathie non ischémique avec une FEVG comprise entre 15 % et 35 %, classe NYHA III malgré un traitement médical optimal.
Design
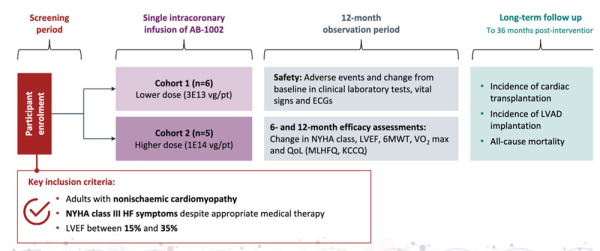
Étude de phase 1 multicentrique, en ouvert, qui évalue 2 doses d’AB-1002 administrée en 1 injection unique intracoronaire (Figure 1)
Cohorte 1 (n=6) : dose faible (6E13 vg/patient)
Cohorte 2 (n=5) : dose élevée (1E14 vg/patient)
vg=vector genome
Figure 1
Objectifs
- Objectif principal : évaluer la sécurité/tolérance de l’AB-1002 à 12 mois
- Objectifs secondaires : évaluer l’efficacité à 12 et 36 mois
Critères de jugement
- Principal : sécurité et tolérance (événements indésirables, biologie, constantes, ECG)
- Secondaires : amélioration de la FEVG, de la classe NYHA, des performances à l’effort (6MWT, VO₂ max), des biomarqueurs (NT-proBNP) et de la qualité de vie (MLHFQ, KCCQ)
Résultats
Sécurité
Au total 11 patients avec une cardiomyopathie sévère ont été inclus : majoritairement des hommes, d’âge moyen, 71 et 59 ans, respectivement dans les cohortes 1 et 2, de FEVG 30% et 23%, avec une espérance de vie à 1 an estimée selon le MAGGIC score à 27 et 25%, et recevant un traitement médical bien conduit.
AB-1002 a été globalement bien toléré. Des événements indésirables, essentiellement bénins à modérés, ont été rapportés chez 9 patients (81,8 %), sans lien direct avec le traitement. Un décès, non imputable à AB-1002, a été observé. Des patients ont présenté une élévation transitoire et asymptomatique des transaminases, en particulier dans la cohorte 2, et 1 patient de la cohorte 1 a présenté un flutter auriculaire.
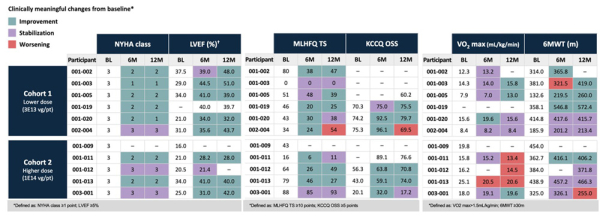
Efficacité (Tableau)
NYHA et FEVG : L’administration d’AB-1002 s’est accompagnée de l’amélioration de plusieurs paramètres : amélioration de la NYHA chez 7/10 patients, amélioration de la FEVG pour 7/9 patients dans les deux cohortes, avec des hausses allant jusqu’à +20 points à 12 mois.
Qualité de vie : Les scores de qualité de vie MLHFQ et KCCQ se sont améliorés chez plusieurs patients. Les gains cliniquement significatifs (>20 points MLHFQ ; >5 points KCCQ) ont été observés dès 6 mois et maintenus à 12 mois chez plusieurs participants.
Capacité fonctionnelle : Les résultats sur la VO₂ max et le test de marche de 6 minutes (6MWT) montrent une amélioration globale, mais avec des réponses variables selon les patients.
VO₂ max : Plusieurs patients ont présenté une amélioration cliniquement significative, notamment dans la cohorte 1 (ex : +5,1 mL/kg/min chez 001-004). À l’inverse, certains patients de la cohorte 2 ont montré une diminution du VO₂ max à 6 et/ou 12 mois, malgré des améliorations sur d'autres critères (classe NYHA, qualité de vie).
6MWT : La majorité des patients ont vu leur distance de marche s’améliorer ou se stabiliser à 6 et 12 mois. Une augmentation jusqu’à +100 mètres a été observée.
Enfin, au niveau moléculaire sur un biopsie d’un patient de la cohorte 3, 13 mois après l’administration, on retrouve une efficacité de la transduction (30 fois supérieure à celle observée chez le porc) et surtout une restauration de la phosphorylation du PLN, calcium-dépendante, altérée dans l’insuffisance cardiaque chronique.
Tableau
Conclusion
La thérapie génique AB-1002 (NAN-101) représente une stratégie innovante ciblant la régulation calcique intracellulaire dans l’insuffisance cardiaque non ischémique avec FEVG réduite.
Les résultats préliminaires de cette étude de phase 1 montrent une bonne tolérance et des signes d’efficacité, avec amélioration de la fonction cardiaque, de la qualité de vie et de la capacité fonctionnelle chez plusieurs patients.
L’étude de phase 2, GenePHIT, randomisée, en double aveugle contre placebo, est en cours aux États-Unis, au Royaume-Uni et dans l’Union européenne pour évaluer l’efficacité sur la réduction de la mortalité cardiovasculaire à 12 mois.
Dans la même thématique
Articles les plus lus
Nex-Z : une révolution génique contre l’amylose cardiaque à transthyrétine
Publié le vendredi 23 mai 2025
Comparaison de l’association iSGLT2/spironolactone contre iSGLT2 seul dans l’insuffisance cardiaque à FEVG préservée
Publié le mardi 27 mai 2025