4 minutes de lecture
OCEAN(a)-DOSE Extension : l’Olpasiran réduit significativement et durablement les taux de Lp(a)
Publié le dimanche 27 août 2023
Auteure :
Emily McDonnell
Membre du Collège des Cardiologues en Formation,
Rouen
Relecteur :
Antonin Trimaille
Membre du Collège des Cardiologues en Formation,
Strasbourg
En direct de l'ESC Congress 2023
D'après la présentation de Michelle O'Donoghue (Boston, États-Unis) : "OCEAN(a)-DOSE Extension"
Les messages clés
- L’Olpasiran est un ARN interférent qui a précédemment démontré son effet sur la réduction significative et dose-dépendante de la concentration plasmatique de Lp(a) à 36 semaines, en comparaison au placebo, dans l’étude de phase 2 OCEAN(a)-DOSE chez des patients bien traités médicalement et avec un profil de sécurité favorable
- Cette étude avait pour objectif d’évaluer l’efficacité et la sécurité de l’Olpasiran après l’arrêt du traitement
- Il existe une réduction persistante des taux de Lp(a) et d’OxPL de manière durable après arrêt du traitement
- Une étude de phase 3 est en cours pour évaluer les effets de l’Olpasiran sur les événements cliniques
Introduction
La lipoprotéine(a) (Lp(a)) est une lipoprotéine LDL-like dans laquelle l’apoliprotéine (b) est liée de manière covalente à l’apolipoproteine(a). L’expression de la Lp(a) est contrôlée par le gène apoliprotéine(a) (LPA). Plusieurs données sont en faveur de l’implication de la Lp(a) dans la physiopathologie de l’athérosclérose, en particulier via son contenu en phospholipides oxidés (OxPL), qui stimulent plusieurs voies pathologiques, telles que l’inflammation de la paroi vasculaire, le dépôt de lipides, la dysfonction endothéliale et la différenciation ostéogénique. Plusieurs stratégies ayant pour but de diminuer les taux circulants de Lp(a) sont actuellement à l’étude.
L’Olpasiran est un ARN interférent (siRNA) qui perturbe l’expression du gène LPA et diminue la synthèse hépatique de Lp(a). L’étude de phase 2 OCEAN(a)-DOSE1 a montré que l’Olpasiran, à une posologie ≥ 75 mg toutes les 12 semaines, ou de 225 mg toutes les 24 semaines, diminuait de façon significative à 36 semaines la concentration plasmatique de Lp(a) en comparaison au placebo et avec un profil de sécurité favorable.
L’objectif de cette étude était d’évaluer l’efficacité et la sécurité de l’Olpasiran après l’arrêt du traitement.
Principe de l'étude, méthodologie et résultats
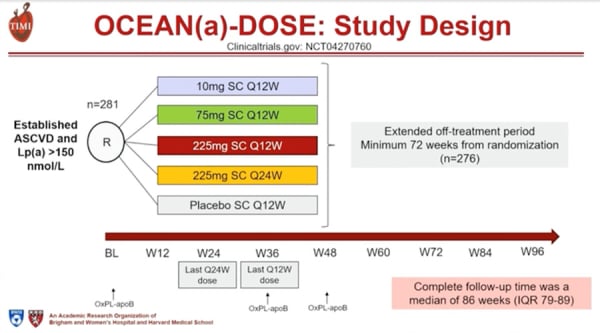
L’étude OCEAN(a)-DOSE a inclus des patients en prévention secondaire avec une maladie athéromateuse connue et un taux de Lp(a) >150 nmol/l.
Il s’agissait d’une étude randomisée répartissant les patients en 5 groupes selon le traitement reçu : soit un placebo, soit l’une des quatre doses d’Olpasiran par voie sous-cutanée (10 mg toutes les 12 semaines, 75 mg toutes les 12 semaines, 225 mg toutes les 12 semaines ou 225 mg toutes les 24 semaines).
La durée de traitement était de 48 semaines.
Pour cette nouvelle analyse, les patients étaient suivis après l’arrêt du traitement, jusqu’à 96 semaines après l’inclusion (durée médiane de suivi de 86 semaines). Les critères de jugement étaient la concentration plasmatique de Lp(a) après arrêt du traitement, le taux d’oxPL-apoB à la 36e et à la 48e semaine, et le profil de sécurité après arrêt du traitement (Figure 1).
Figure 1 : Design de l'étude
Au total, 281 patients ont été inclus (âge moyen 62 ans, 32,0 % de femmes) avec, au départ, une concentration médiane de Lp(a) de 260.3 nmol/L et un taux médian de LDL-C de 67.5 mg/dL.
Les patients de l'essai bénéficiaient d’un traitement médical optimal dans la majorité des cas, avec 88 % d'entre eux sous statines, dont 61 % avec des statines de forte intensité. Plus de la moitié des patients était sous Ezétimibe, et 23 % prenaient un inhibiteur de PCSK9.
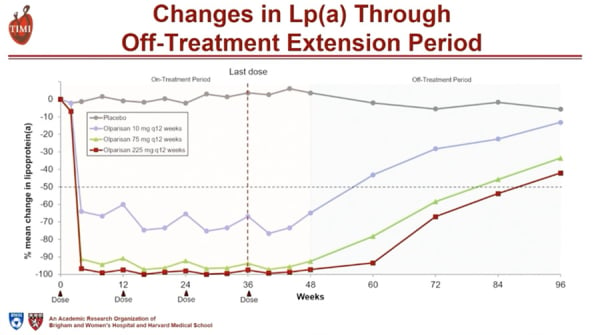
Après arrêt du traitement, on observe une augmentation progressive des taux de Lp(a), avec maintien d’un taux diminué de 40 à 50 % en comparaison avec le placebo, pour des posologies d’Olpasiran d’au-moins 75 mg/12 semaines, à 1 an de la fin du traitement (Figure 2).
Figure 2 : Concentrations plasmatiques de Lp(a) pendant la période d’extension sans traitement
Une évolution similaire des taux de Lp(a) a été observée pour la posologie de 225 mg / 24 semaines, avec un taux de Lp(a) diminué de 30 % par rapport au placebo à 1 an de la fin du traitement.
L’Olpasiran a permis des diminutions marquées des taux d’OxPL, avec une diminution ajustée au placebo jusqu’à 104,7 % à la 48e semaine, à la posologie de 225 mg toutes les 12 semaines. On observe un effet dose-dépendant de l’Olpasiran sur les taux d’OxPL.
Les effets secondaires (myalgies, atteinte hépatique, hyperglycémie, réaction d’hypersensibilité) étaient rares pendant la période de traitement et sont restés équilibrés entre les différents groupes après l’arrêt du traitement. Les réactions d’hypersensibilité n’ont pas augmenté après la fin du traitement.
Conclusion
L’Olpasiran permet une réduction robuste des taux circulants de Lp(a) pour des posologies ≥ 75 mg toutes les 12 semaines, avec la persistance d’une réduction significative des taux de Lp(a) à 1 an de la dernière administration.
Ce médicament entraine également une réduction dose-dépendante et durable des OxPL.
Enfin, le profil de sécurité de l’Olpasiran semble favorable, aussi bien pendant la période de traitement qu’après celle-ci.
Pour aller plus loin
Il a été précédemment démontré que le taux circulant de Lp(a) est significativement corrélé au développement de l’athérosclérose. De même, les OxPL portés par la Lp(a) stimulent plusieurs voies délétères impliquées dans le développement de l’athérosclérose. Du fait de son effet bénéfique marqué sur ces deux paramètres, l’Olpasiran semble une stratégie très intéressante pour diminuer le risque cardiovasculaire chez des patients en prévention secondaire.
Une étude de phase 3 permettant de juger l’effet de ce médicament sur les événements cliniques est en cours (NCT05581303). Ses résultats sont très attendus pour faire entrer l’Olpasiran dans notre pratique clinique.
Référence bibliographique
O’Donoghue ML, Rosenson RS, Gencer B, López JAG, Lepor NE, Baum SJ, et al. Small Interfering RNA to Reduce Lipoprotein(a) in Cardiovascular Disease. N Engl J Med. 2022 Nov 17;387(20):1855–64.
Pour en savoir plus, consultez les LBS, LBT et hotlines complètes, en langue anglaise, présentées lors de l'ESC 2023 :
Toute l'actualité de l'ESC 2023
Cette couverture de congrès vous est proposée grâce au soutien institutionnel de
l'alliance Boehringer Ingelheim - Lilly, de CSL Vifor et de Sanofi
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio-online ou de la SFC, et n'engage pas leur responsabilité.
|
Dans la même thématique
Articles les plus lus

Quelle place potentielle pour l’acide bempédoïque ?
Publié le mercredi 11 octobre 2023
Effets rénaux du sacubitril/valsartan chez les patients IC à FEVG > 40 % : une analyse poolée des études PARAGLIDE-HF et PARAGON-HF
Publié le samedi 26 août 2023