5 minutes de lecture
Un ventricule qui s’autolyse
Publié le lundi 9 juin 2025
Madame X., 80 ans est suivie pour une CMH obstructive diagnostiquée en février 2020. Elle est adressée par un hôpital périphérique en hôpital de jour pour bilan complémentaire de cardiomyopathie hypertrophique.
Contexte clinique
Ce patient a été pris en charge par l'équipe l’équipe d’explorations fonctionnelles cardiovasculaires, de l’USIC et de chirurgie cardiaque du CHU de Lille : Pr David Montaigne, Dr Hélène Ridon, Pr Augustin Coisne, Dr Natacha Rousse, Pr Gilles Lemesle, le Dr Charlotte Potelle, le Dr Cédric Delhaye, le Pr Pontana.
Présentation du cas
Cette patiente présente comme antécédents :
- Une cardiomyopathie hypertrophique obstructive diagnostiquée en février 2020
- Un rétrécissement aortique modéré avec une vitesse maximale trans-aortique à 3,3 m/s et un gradient moyen trans-aortique à 27 mmHg sur une dernière échocardiographie en janvier 2022
- Une fibrillation atriale persistante avec un score de CHADS-VA à 3/8
- Une hypertension artérielle
Son traitement comporte :
- APIXABAN 5 mg matin et soir
- ATENOLOL 50 mg 2 fois par jour
- PERINDOPRIL 5 mg par jour
- AMLODIPINE 5 mg par jour
- AMIODARONE 200 mg par jour
Elle vit avec son mari au domicile. Elle est autonome dans les activités de la vie quotidienne et n’a pas d’aide présente au domicile.
Son principal symptôme est une dyspnée d’effort côtée NYHA IIB-III. Elle ne présente pas de syncope ni de lipothymie. Elle ne présente pas d’angor.
Son bilan biologique retrouve une hémoglobine à 14 g/dL, créatinine à 10 mg/L, troponine à 17 ng/L, NT pro BNP 622 ng/L.
Son électrocardiogramme déroule un rythme sinusal régulier à 50 ppm. Un axe gauche sur bloc de branche incomplet avec un bloc atrio-ventriculaire du 1er degré.
Elle est suivie dans un hôpital de périphérie et est adressée au CHU pour un premier bilan complémentaire comprenant une IRM cardiaque, une échocardiographie, un Holter-ECG. Des prélèvements génétiques sont également réalisés.
Autres examens réalisés
IRM
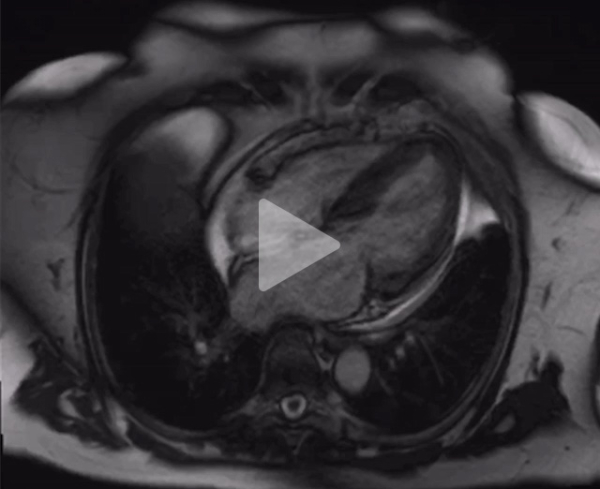
- Son IRM cardiaque est la suivante (Vidéo 1) et retrouve :
- Un aspect de cardiomyopathie hypertrophique sarcomérique
- Une fraction d’éjection du ventricule gauche à 62%
- Une hypertrophie ventriculaire gauche asymétrique mesurée au maximum à 20 mm
- Une fibrose interstitielle intra-septale
- Une insuffisance mitrale modérée
Vidéo 1 : IRM cardiaque en séquence ciné en coupe 4 cavités
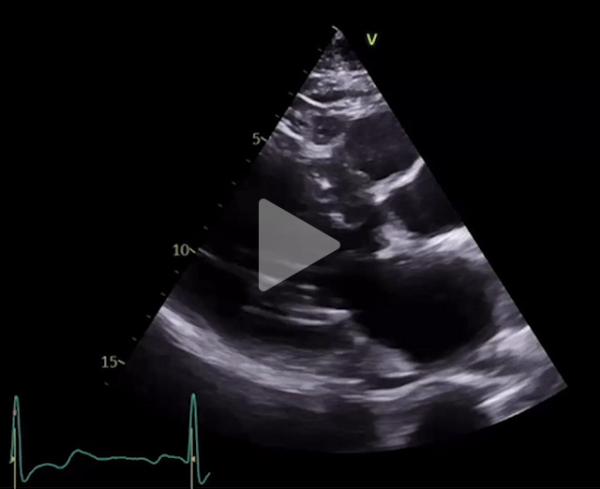
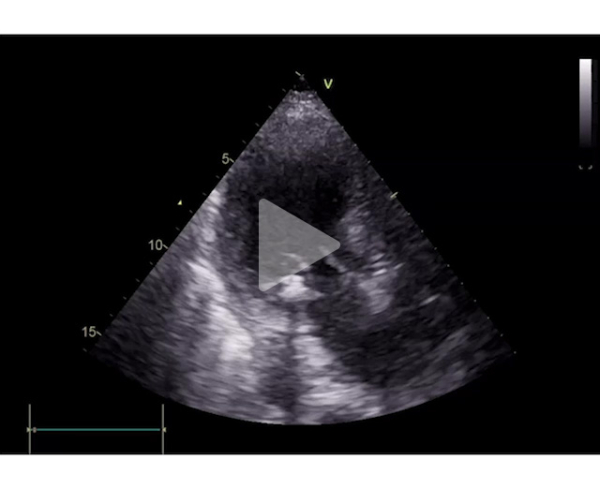
Son échocardiographie est la suivante (Vidéo 2, Figures 1,2,3,4 et 5) et retrouve :
- Une FEVG à 70%
- Un Strain longitudinal global à -13,9%
- Une ébauche de SAM
- L’absence d’obstruction sous aortique significative
- Des piliers hypertrophiques
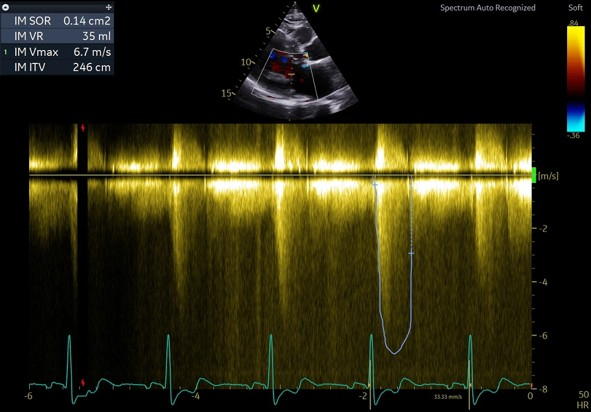
- Un rétrécissement aortique avec des critères discordants : vitesse maximale sous aortique à 4,2 m/s avec un gradient moyen à 37 mmHg
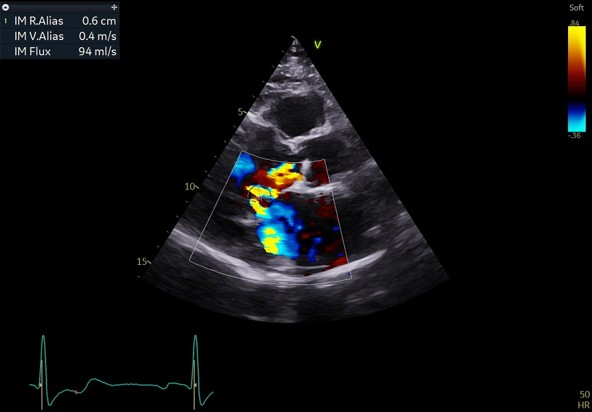
- Une insuffisance mitrale centrale modérée avec volume régurgité à 35 mL, une surface d’orifice régurgitant à 13mm^2
Vidéo 2 : échographie en coupe parasternale grand axe
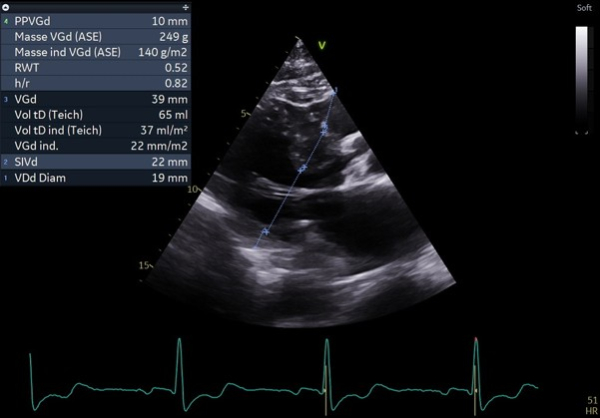
Figure 1 : ETT en coupe parasternale grand axe avec épaisseur maximale du septum inter-ventriculaire mesurée à 22 en septal basal
Figure 2 : quantification de la fuite mitrale par la méthode de la PISA
Figure 3 : quantification de la fuite mitrale par la méthode de la PISA
Figure 4 : utilisation de la sonde de Pedoff permettant de recueillir une vitesse maximale trans-aortique à 4,2m/s
Figure 5 : flux Doppler continu en trans-aortique avec une vitesse maximale à 4,2 m/s et un gradient moyen à 37 mmHg
Holter ECG
Le Holter-ECG est réalisé pour l’aide au calcul du risque de mort subite à 5 ans. Celui-ci ne retrouve que huit extrasystoles ventriculaires isolées sans tachycardie ventriculaire associée.
Le risque de mort subite à 5 ans est estimé à 1,14% et il n’est donc pas retenu d’indication de défibrillateur en prévention primaire.
Figure 6
Score calcique valvulaire
Un score calcique valvulaire est réalisé pour s’assurer du caractère serré du rétrécissement aortique
Devant des critères échocardiographiques discordants, la patiente est reconvoquée pour la réalisation d’un score calcique valvulaire. Le score valvulaire aortique revient à 1290 UA et le rétrécissement est donc considéré comme serré (>1200 UA chez la femme).
Vidéo 3 : score calcique valvulaire
Echographie de contrôle
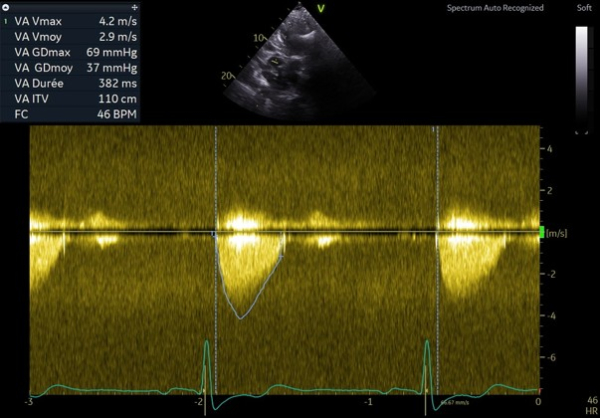
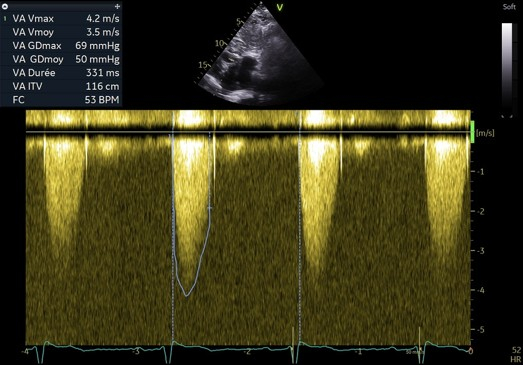
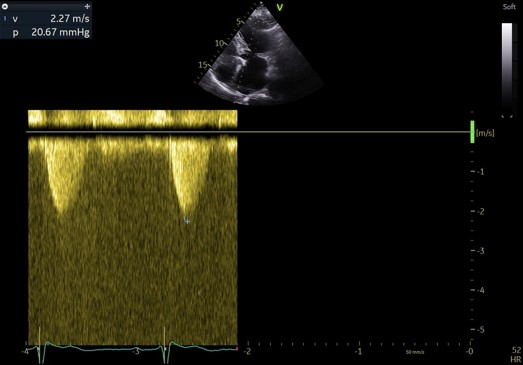
La patiente est également revue à 3 mois pour réévaluer le rétrécissement aortique et s’assurer l’absence d’obstruction sous aortique. Le rétrécissement aortique est désormais serré avec des critères concordants : une vitesse maximale à 4,2 m/s avec un gradient moyen à 50 mmHg. L’insuffisance mitrale est toujours modérée et centrale. Il n’y a pas d’obstruction sous aortique significative malgré les manoeuvres de provocation telles que le Valsalva et l’évaluation échocardiographique en post prandial. Le gradient maximal est estimé à 20 mmHg avec une vitesse maximale à 2,2 m/s.
Dans ce contexte, la patiente est adressée pour prise en charge de son rétrécissement aortique par TAVI.
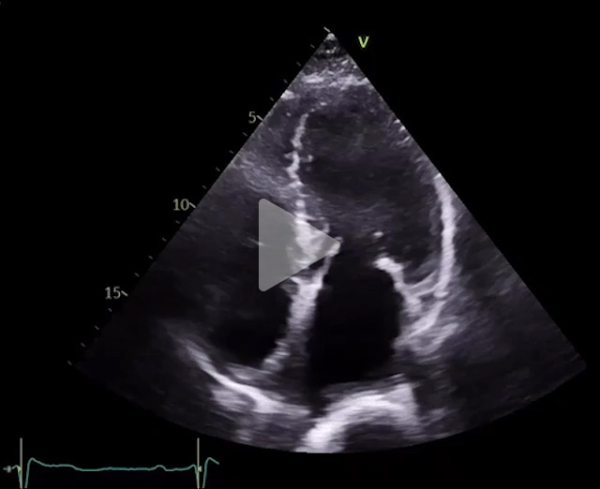
Vidéo 4 : coupe apicale 4 cavités
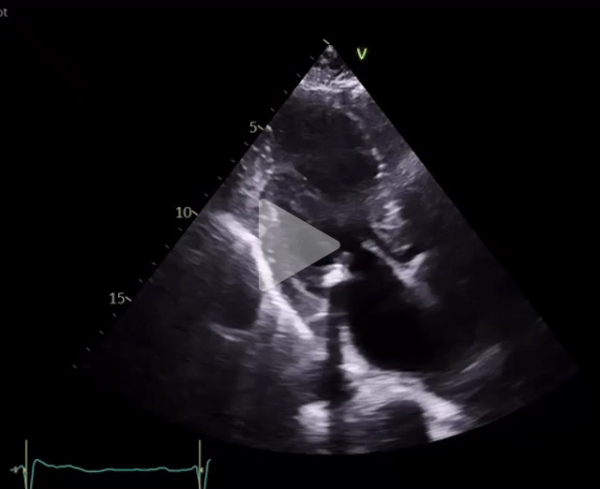
Vidéo 5 : coupe apicale 3 cavités
Figure 7 : flux doppler continu trans-aortique montrant une vitesse maximale à 4,2 m/s et gradient moyen à 50 mmHg
Figure 8 : flux doppler continu sans obstruction signicative malgré les manoeuvres de provocation
Bilan pré TAVI
Un bilan pré TAVI est réalisé comprenant :
- Une coronarographie normale
- Une consultation d’anesthésie
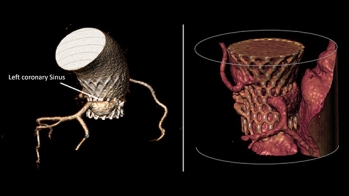
- Un angioscanner pré TAVI
TAVI
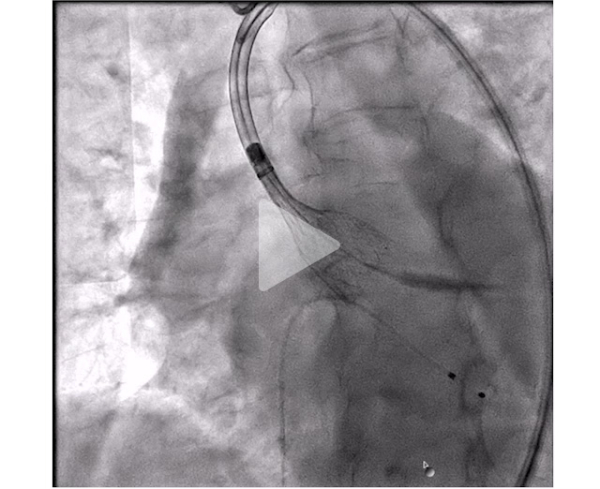
La patiente bénéficie de l’implantation d’une valve TAVI Evolut Fx 26 mm par voie fémorale droite avec voie secondaire radiale droite.
Vidéo 6 : déploiement de la prothèse Evolut Fx
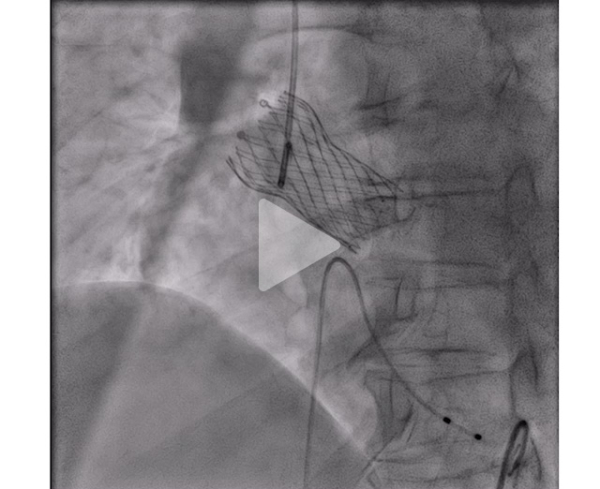
Vidéo 7 : contrôle scopie en fin de procédure avec bon déploiement sans fuite
Evolution post-TAVI
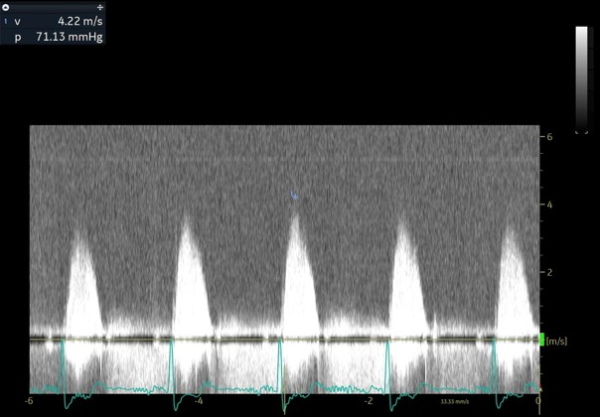
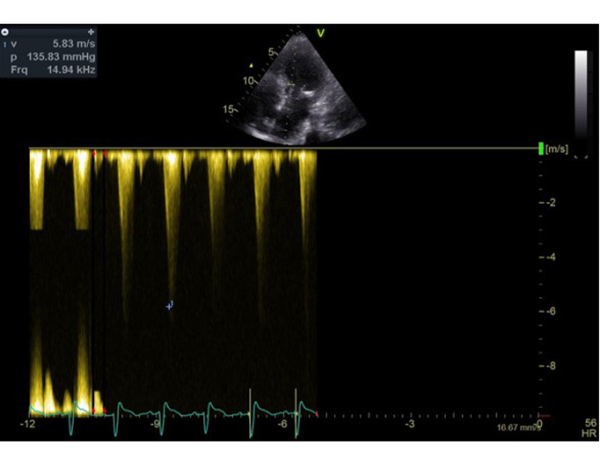
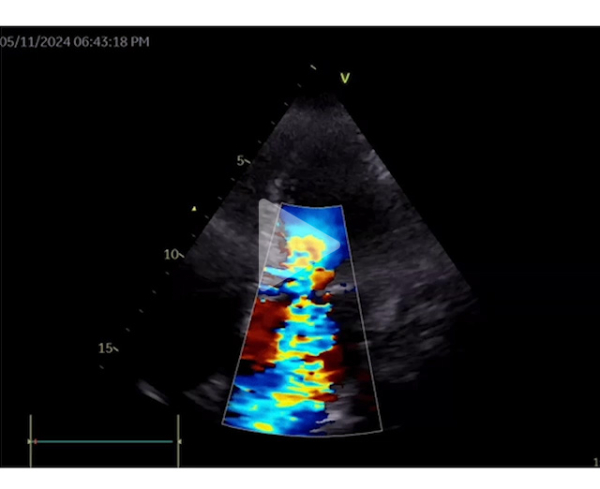
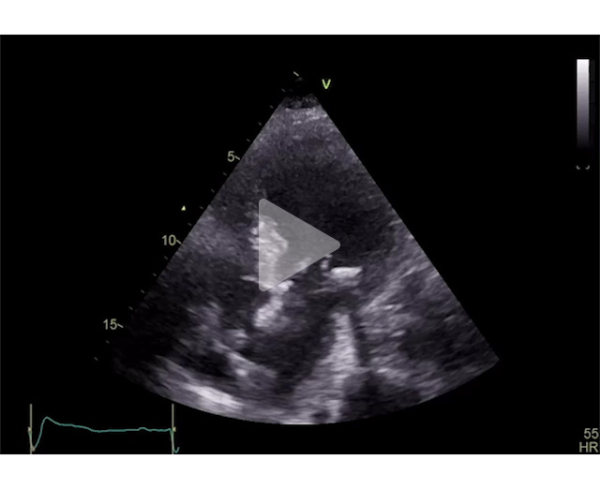
Deux jours après l’implantation du TAVI, l’évolution est marquée par une dénaturation avec un oedème aigu pulmonaire nécessitant l’introduction d’une ventilation non invasive en alternance avec de l’oxygénothérapie à haut débit nasal. Le contrôle échocardiographique montre l’apparition d’une obstruction majeure sur SAM complet avec un gradient maximal à 120 mmHg. Il existe également une insuffisance mitrale sévère en relation avec un SAM très sévère, un ventricule gauche hyperkinétique, une fraction d’éjection à 75%. La prothèse TAVI fonctionne bien cependant.
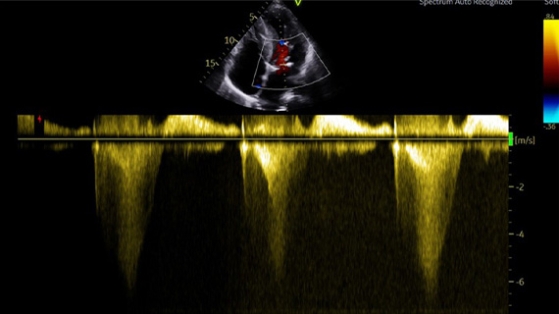
Figure 9 : flux doppler continu montrant l’apparition d’une obstruction sous aortique avec une vitesse maximale à plus de 30 mmHg
Vidéo 8 : insuffisance mitrale sévère avec SAM complet en coupe apicale 4 cavités
Vidéo 9 : coupe apicale 4 cavités montrant un VG hyperkinétique avec apparition d’un SAM
Vidéo 10 : coupe apicale 3 cavités avec SAM complet
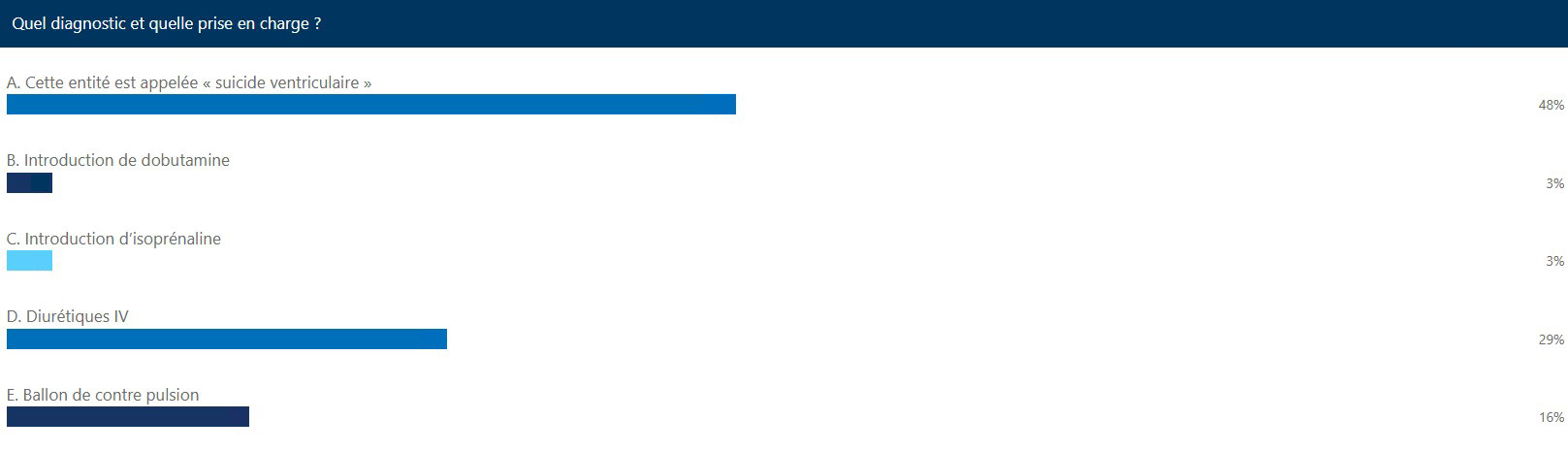
Le résultat du questionnaire :
Diagnostic
La bonne réponse est : A - Cette entité est appelée « suicide ventriculaire »
Traitement et gestion du cas
CMH obstructive
Après discussion collégiale entre cardiologues, chirurgiens et anesthésistes, il a été proposé :
- Expansion volémique
- SEES avec objectif de désynchronisation
- Landiolol
- Introduction de Mavacamten ? Non, hors AMM
- Discussion de Mitraclip ? Problématique de volumineuse calcification du feuillet mitral postérieur + feuillet postérieur court
- Discussion de prise en charge chirurgicale si échec de la prise en charge médicale
Après désynchronisation, introduction du landiolol et remplissage vasculaire :
- Persistance du SAM et de l’IM sévère associée
- Finalement dégradation respiratoire dans la nuit sous Optiflow avec décision d’IOT
- Donc prise en charge chirurgicale retenue après concertation entre cardiologues, chirurgiens et anesthésistes
Opération
- Dépose du TAVI
- Remplacement valvulaire mitral bioprothétique
- Myectomie et remplacement valvulaire aortique bioprothétique
- Exclusion d’auricule gauche
Discussion- traitements du suicide ventriculaire
Place de l’IMPELLA dans la CMH obstructive ?
- Reste une option à discuter, permet le shunt de l’obstruction
- En attendant l’efficacité du traitement médical ?
- Pour essayer de temporiser une alcoolisation septale ? Une myectomie ?
Figure 10
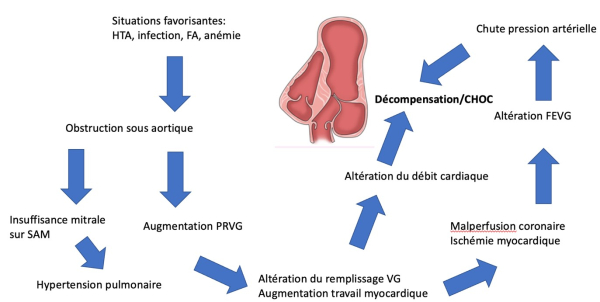
Discussion
Traitements de la CMH en choc obstructif ont pour but de maintenir une précharge et une post charge VG pour garder un remplissage VG et atténuer l’hypercontractilité VG.
Figure 11
Conclusion
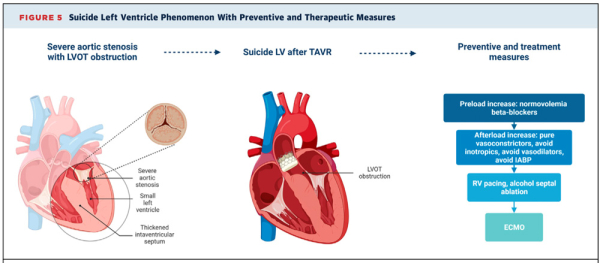
- Le suicide ventriculaire est une complication peu fréquente mais sévère qui peut survenir en post implantation de TAVI
- Dégradation hémodynamique et/ou respiratoire due à une obstruction post TAVI avec SAM +/- IM
- Le + souvent : femme, petit ventricule, hypercontractilité, gradient intraVG pré TAVI dans la moitié des cas
- TTT : remplissage, BB-, NAD, SEES, alcoolisation, myectomie, (place de l’Impella ?)
Figure 12
Abstract 16850 : Suicide Left Ventricle After Transcatheter Aortic valve Replacement. A systematic Review, Diego Barzallo et al.
Références
1. Overcoming the Obstacle of Suicide Left Ventricle After Transcatheter Aortic Valve Replacement Phenomenon, Leonidas Koliastasis et al.
2. Abstract 16850 : Suicide Left Ventricle After Transcatheter Aortic valve Replacement. A systematic Review, Diego Barzallo et al.
Ce concours vous est proposée avec le soutien institutionnel de :
Ce cas ne représente pas l’opinion de la SFC ni de Cardio-online, et n’engage pas leur responsabilité.
Articles les plus lus
Le SAM, c’est celui qui ne boit pas !
Publié le 26 mars 2025
Imagerie cardiaque : cas clinique "Attention infarctus du myocarde méchant !"
Publié le dimanche 23 octobre 2022
Imagerie cardiaque : cas clinique "Toutes les hypertrophies ventriculaires gauches ne se valent pas !"
Publié le mardi 26 juillet 2022