7 minutes de lecture
VIP-ACS : après SCA, la double dose de vaccin antigrippal ne fait pas mieux que la dose standard sur le pronostic cardiovasculaire
Publié le lundi 29 août 2022
Auteur :
Louis Perrard
Membre du Collège des Cardiologues en Formation,
Amiens
Relecteur :
Théo Pezel
Membre du Collège des Cardiologues en Formation,
Paris
Sous la supervision de :
Albert Hagège
Président du Comité Éditorial de Cardio-online,
Paris
En direct de l'ESC Congress 2022
D'après la présentation de Remo Holanda De Mendonca Furtado (Sao Paulo, Brésil) : "Influenza Vaccine Among Patients with Acute Coronary Syndromes: the VIP-ACS trial".
Messages clés
- Chez les patients hospitalisés pour syndrome coronaire aigu, la vaccination anti-grippale double dose intra-hospitalière ne réduit pas les évènements cardiovasculaires et pulmonaires à 1 an, par rapport à la vaccination standard.
- Cette étude ne remet pas en cause l’importance de la vaccination anti-grippale chez les patients à haut risque cardiovasculaire.
Introduction
Les syndromes coronaires aigus (SCA) représentent la 1ère cause de mortalité mondiale1. Leur prise en charge est aujourd’hui bien standardisée (revascularisation coronaire et traitement médical optimal). Malgré cela, il persiste un risque de récidive d’infarctus du myocarde en prévention secondaire2, avec une place pour de nouvelles thérapeutiques.
Des études observationnelles récentes suggèrent qu’une infection par le virus de la grippe serait associée à une augmentation des évènements cardiovasculaires (CV)3. Les mécanismes impliqués seraient immunitaires, via la cascade inflammatoire engendrée, et mécaniques, via l’induction d’une instabilité des lésions coronaires sous-jacentes4.
Dans ce contexte, une méta-analyse d’essais randomisés suggère que le vaccin contre la grippe (versus placebo) permettrait une réduction à 1 an des évènements cardiovasculaires majeurs (MACE) en post-SCA5.
À ce jour, l’impact d’une vaccination anti-grippale précoce en post-SCA (versus vaccination standard à distance) n’a pas été évalué6. La récurrence plus élevée d’évènements dans les 3 mois post-SCA (versus suite du suivi)7 a incité les auteurs à proposer une vaccination précoce pour réduire ce risque.
De plus, d’autres études suggèrent qu’une augmentation de la dose vaccinale améliorerait son immunogénicité et réduirait le risque d’infections respiratoires et d’hospitalisation8. Cela semble intéressant ici. En effet, les patients atteints de maladies cardiovasculaires (MCV) (versus patients indemnes) présentent une plus faible réponse humorale au vaccin anti-grippal (VAG)9.
L’objectif de cette étude était donc d’évaluer l’efficacité d’une vaccination antigrippale renforcée en post-SCA.
Méthodologie et résultats
Essai randomisé de supériorité, multicentrique, ouvert (avec toutefois une mise en aveugle d’un comité d’adjudication indépendant concernant les critères de jugement).
Les patients étaient inclus s’ils avaient au moins 18 ans et étaient hospitalisés pour un SCA (avec ou sans élévation du segment ST).
Les critères d’exclusion comportaient la participation à un autre essai clinique portant sur la vaccination, un refus de consentement, un antécédent d’hypersensibilité et/ou d’anaphylaxie envers un composant du vaccin, un syndrome de Guillain-Barré survenu dans les 6 semaines après une précédente injection de VAG, avoir déjà été vacciné contre la grippe durant la saison, l’allaitement, la grossesse, le fait d’avoir présenté un SCA durant les mois de décembre, janvier et février (pas d’incidence de la grippe au Brésil durant cette période), un SCA avec une durée d’hospitalisation supérieure à 7 jours.
Les patients dans le groupe expérimental recevaient une double dose du vaccin quadrivalent inactivé antigrippal pendant l’hospitalisation pour SCA, et les patients du groupe témoin recevaient une dose standard du vaccin 30 jours après leur sortie d’hospitalisation.
Le critère de jugement principal était composite et comprenait à 1 an, la mort, l’infarctus du myocarde (IDM), l’accident vasculaire cérébral (AVC), une hospitalisation pour angor instable, insuffisance cardiaque ou infection respiratoire (excluant le COVID-19), une revascularisation coronaire en urgence.
Les critères de jugements secondaires étaient nombreux. Le critère clé était les MACE (décès d’origine cardiovasculaire, IDM, AVC). Les autres comprenaient la mortalité totale ; la mortalité cardiovasculaire ; le taux d’IDM, d’hospitalisation pour angor instable, d’AVC, d’accident ischémique transitoire (AIT), d’hospitalisation pour insuffisance cardiaque, pour infection respiratoire, de revascularisation coronaire (en urgence ou non), de thrombose de stent, d’hospitalisations pour COVID-19.
À noter que l’étude a été réalisée entre juin 2019 et novembre 2020, soit pendant la pandémie due au SARS-CoV-2, avec pour effets directs une VAG anticipée au Brésil et un recrutement limité. Le « steering comity » a décidé, dans ce contexte, de modifier la méthode d’analyse. Initialement prévue selon la survenue du 1er événement au cours du temps, elle a finalement été réalisée selon la technique du win ratio, en comparant 1 à 1 les patients de chaque groupe, de façon non appariée. Une analyse a également était faite en utilisant une régression logistique avec un modèle de Cox non ajusté.
Une analyse de sécurité a été réalisée chez les patients randomisés, ayant reçu le traitement.
Parmi les 5 362 patients présélectionnés dans 25 centres Brésiliens, 1 801 patients ont été inclus, 896 dans le groupe expérimental et 905 dans le groupe témoin. Il s’agissait principalement d’hommes (70 %), d’âge médian 57 ans, fumeurs actifs (58 %), hypertendus (68 %). On note également 27,5 % de diabétiques, 16,2 % d’antécédents d’IDM et 48 % de SCA avec sus-décalage du segment ST. Il n’y avait pas de différence significative entre les groupes.
La vaccination a été administrée à 98 % du groupe expérimental et 88 % du groupe témoin, avec 1 seul patient perdu de vue dans le groupe témoin. L’analyse a été réalisée en intention de traiter.
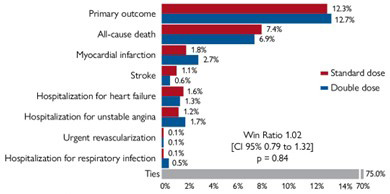
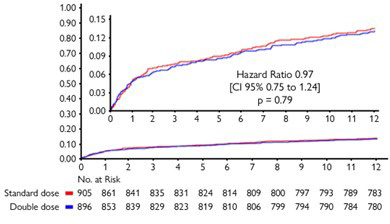
L’analyse statistique ne retrouve pas de différence significative entre les groupes concernant le critère de jugement principal (Figure 1 : win ratio 1,02, IC 95 % [0,79–1,32], p = 0,84 ; Figure 2 : temps avant événement HR 0,97, IC 95 % [0,75–1,24] p = 0,79).
Figure 1 – Histogramme du critère de jugement principal à 12 mois selon la méthode du win ratio.
Source: présentation de Harald Sourij (Graz, Autriche), ESC 2022
Figure 2 – Courbes de Kaplan-Meyer du critère de jugement principal à 12 mois selon l’analyse de survenue de l’événement au cours du temps.
Source: présentation de Remo Holanda De Mendonca Furtado (Sao Paulo, Brésil), ESC 2022
Une analyse en sous-groupes et une analyse de sensibilité incluant les hospitalisations pour COVID-19 retrouvent des résultats similaires.
Il en est de même concernant les critères de jugement secondaires, avec notamment, pour les MACE, un win ratio à 0,94 (IC 95% [0,66–1,33], p = 0,72) et dans l’analyse, selon le temps avant événement, un HR à 1,06 (IC 95 % [0,75–1,51], p = 0,73).
L’analyse de sécurité retrouve une bonne tolérance globale de la vaccination dans les 2 groupes. Le principal effet indésirable était une douleur au niveau du site d’injection (9,5 %). Seuls 5 % des patients ont rapporté un événement indésirable grave, sans différence significative entre les groupes.
Conclusion
La vaccination antigrippale double dose intra-hospitalière après un SCA n’améliore pas les comorbidités cardiorespiratoires à 12 mois, par rapport à une vaccination simple dose standard à distance de l’hospitalisation.
La vaccination double dose n’est pas associée à une majoration des effets indésirables. Les auteurs suggèrent de répartir la dose de vaccin entre 2 membres pour diminuer les effets indésirables.
Ces résultats sont cohérents avec d’autres études de la littérature, telles que INVESTED, réalisée chez les patients ayant réalisé un SCA récent ou ayant été hospitalisés pour insuffisance cardiaque.
Les auteurs expliquent ces résultats par le fait que la dose standard de vaccin soit suffisante pour la prévention cardiorespiratoire des patients à haut risque CV ; un timing de vaccination inadéquat et les nombreuses contraintes liées à la pandémie COVID.
Citons le recrutement limité ayant entrainé un manque de puissance (même si l’impact sur les résultats paraît modeste) et la moindre diffusion du virus de la grippe dûe au port du masque, ayant désavantagé l’étude.
Concernant les limites de l’étude, cet essai présente plusieurs biais. Le changement de la méthode d’analyse, malgré la tentative par les auteurs de maintien de l’aveugle, expose à d’autres biais de classement et de confusion.
Par ailleurs, la vaccination antigrippale chez les patients à haut risque cardiovasculaire demeure primordiale. De nouvelles stratégies visant à améliorer l’adhésion à la vaccination de ces patients semblent pertinentes.
Références bibliographiques
- Bergmark BA, Mathenge N, Merlini PA, Lawrence-Wright MB, Giugliano RP. Acute coronary syndromes. Lancet Lond Engl. 2022 Apr 2;399(10332):1347–58.
- Michos ED, Udell JA. Am I Getting the Influenza Shot Too?: Influenza Vaccination as Post-Myocardial Infarction Care for the Prevention of Cardiovascular Events and Death. Circulation. 2021 Nov 2;144(18):1485–8.
- Warren-Gash C, Blackburn R, Whitaker H, McMenamin J, Hayward AC. Laboratory-confirmed respiratory infections as triggers for acute myocardial infarction and stroke: a self-controlled case series analysis of national linked datasets from Scotland. Eur Respir J. 2018 Mar;51(3):1701794.
- Lee HS, Noh JY, Shin OS, Song JY, Cheong HJ, Kim WJ. Matrix Metalloproteinase-13 in Atherosclerotic Plaque Is Increased by Influenza A Virus Infection. J Infect Dis. 2020 Jan 2;221(2):256–66.
- Behrouzi B, Bhatt DL, Cannon CP, Vardeny O, Lee DS, Solomon SD, et al. Association of Influenza Vaccination With Cardiovascular Risk: A Meta-analysis. JAMA Netw Open. 2022 Apr 1;5(4):e228873.
- Davis MM, Taubert K, Benin AL, Brown DW, Mensah GA, Baddour LM, et al. Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association/American College of Cardiology. J Am Coll Cardiol. 2006 Oct 3;48(7):1498–502.
- Zimerman A, Lopes RD, Stebbins AL, Guimarães PO, Haque G, Melloni C, et al. Pooled analysis of adverse event collection from 4 acute coronary syndrome trials. Am Heart J. 2016 Apr;174:60–7.
- DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 2014 Aug 14;371(7):635–45.
- Van Ermen A, Hermanson MP, Moran JM, Sweitzer NK, Johnson MR, Vardeny O. Double dose vs. standard dose influenza vaccination in patients with heart failure: a pilot study. Eur J Heart Fail. 2013 May;15(5):560–4.
Pour en savoir plus, consultez les Late-breaking trials complets, en langue anglaise, présentées lors de l'ESC 2022 :
Toute l'actualité de l'ESC 2022
Ce compte rendu de l'ESC 2022 vous est proposé avec le soutien institutionnel de :
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio Online ou de la SFC, et n'engage pas leur responsabilité.
|
Dans la même thématique
Articles les plus lus
FA et maladie coronaire
Publié le 26 janvier 2022
PROFID : l’IRM cardiaque améliore la prédiction du risque de mort subite en post-infarctus
Publié le lundi 18 avril 2022