5 minutes de lecture
AI-ENHANCED : l’intelligence artificielle, nouvel outil diagnostique du rétrécissement aortique ?
Publié le samedi 27 août 2022
Auteur :
Nicolas Rivière
Membre du Collège des Cardiologues en Formation,
Bordeaux
Relecteur :
Guillaume Bonnet
Membre du Collège des Cardiologues en Formation,
Bordeaux
Sous la supervision de :
Albert Hagège
Président du Comité Éditorial de Cardio-online,
Paris
En direct de l'ESC Congress 2022
D'après la présentation de Catherine M Otto (Seattle, United States of America) : "AI-ENHANCED detection of Aortic Stenosis"
Messages clés
- L’algorithme d’intelligence artificielle créé a une excellente capacité pour détecter et classer correctement le rétrécissement aortique serré.
- Le rétrécissement aortique est associé à un taux mortalité élevé à 5 ans, 56 % pour le rétrécissement aortique modéré et 68 % pour le rétrécissement aortique serré.
- Cette étude est une première étape clé. L’intelligence artificielle pourrait dans le futur être une aide pour le clinicien, notamment en cas d’incertitude diagnostique.
Introduction
Le rétrécissement aortique est la valvulopathie la plus fréquente. La prévalence augmente avec l’âge et dépasse 7 % au-delà de 80 ans1,2. Une fois symptomatique, le pronostic est sombre avec un taux de mortalité proche de 50 % à 2 ans3. De plus, les recommandations européennes sont claires sur la prise en charge du rétrécissement aortique serré avec une indication de grade IA de remplacement valvulaire rapide à l’apparition des symptômes4. Pour autant, le rétrécissement aortique est encore largement sous diagnostiqué et sous-traité5.
L’objectif principal de cette étude était de créer puis d’évaluer un algorithme d’intelligence artificielle pour détecter le rétrécissement aortique à partir de données échographiques usuelles. Puis prédire la mortalité à 5 ans en fonction de la sévérité du rétrécissement aortique.
Méthodologie et résultats
L’algorithme d’IA a été entrainé et testé à partir des données de la National Echo Database of Australia (NEDA), qui contient plus de 1 million d’échographies sur plus de 630 000 patients, issues de 23 centres Australiens. Les patients aux antécédents de remplacement valvulaire aortique ont été exclus. Le critère de performance diagnostic de l’algorithme d’IA était la surface valvulaire aortique < 1 cm2.
L’algorithme d’IA a été entrainé sur 70 % des données NEDA sélectionnées au hasard puis testé sur les 30 % restantes. Le critère de jugement principal était la capacité de l’algorithme d’IA à détecter et classer correctement le rétrécissement aortique en fonction de sa sévérité. Trois groupes ont été créés : faible probabilité de rétrécissement aortique, haute probabilité de rétrécissement aortique modéré et haute probabilité de rétrécissement aortique serré.
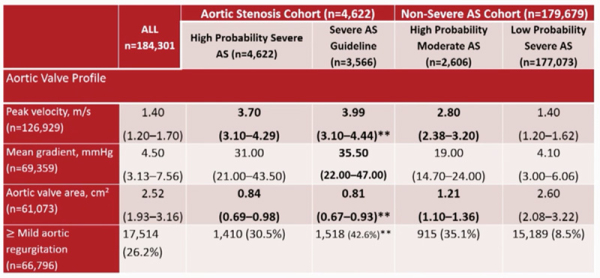
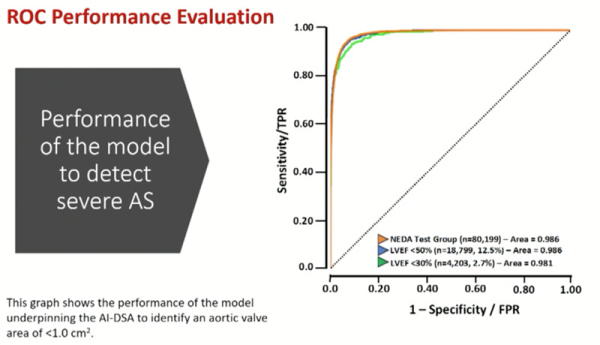
L’algorithme a été testé sur 184 301 patients, 177 013 ont été classés faible probabilité de rétrécissement aortique (96 %), 2606 haute probabilité de rétrécissement aortique modéré (1,4 %) et 4622 haute probabilité de rétrécissement aortique serré (2,5 %) (Figure 1). L’aire sous la courbe était excellente à 0,986 (Figure 2) et 100 % des rétrécissements aortiques serrés selon les recommandations ont été correctement classés dans le groupe haute probabilité de rétrécissement aortique serré.
Figure 1 : Données échographiques des 3 groupes formés par l’intelligence artificielle
Source: présentation de Catherine M Otto (Seattle, United States of America), ESC 2022
Figure 2 : Courbe ROC de l’algorithme d’IA pour détecter un rétrécissement aortique
Source: présentation de Catherine M Otto (Seattle, United States of America), ESC 2022
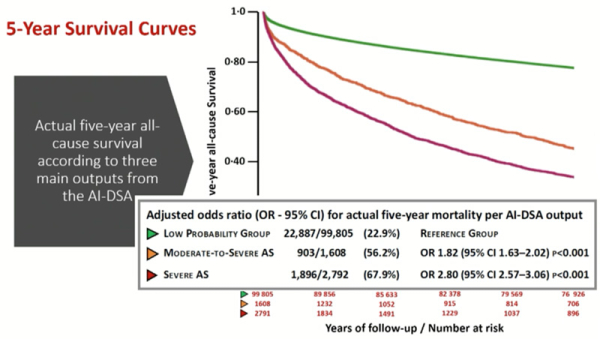
La mortalité à 5 ans était respectivement de 23 %, 56 % et 68 % dans les groupes faible probabilité de rétrécissement aortique, haute probabilité de rétrécissement aortique modéré et haute probabilité de rétrécissement aortique serré (Figure 3). L’Odd ratio était de 1,82 (95 % CI 1,63-2,02) p < 0,001 pour la haute probabilité de rétrécissement aortique modéré et de 2,80 (95 % CI 2,57-3,06) p < 0,001 pour la haute probabilité de rétrécissement aortique serré.
Figure 3 : Survie à 5 ans en fonction de la sévérité du rétrécissement aortique
Source: présentation de Catherine M Otto (Seattle, United States of America), ESC 2022
Enfin, 1056 patients supplémentaires ont été classés par l’algorithme d’IA comme haute probabilité de rétrécissement aortique alors qu’ils n’avaient pas les critères échographiques de rétrécissement aortique serré selon les recommandations. De plus, ces patients avaient une mortalité à 5 ans élevée et très proche de celle des rétrécissements aortiques serrés définis par les recommandations en vigueur.
L’hypothèse d’une meilleure capacité diagnostique de l’algorithme d’IA pour diagnostiquer les rétrécissements aortiques serrés en lien avec des critères échographiques actuels trop restrictifs est soulevée par les auteurs. Cependant, la principale limite à cette hypothèse est un taux important de données échographiques manquantes (52 %), exposant à un biais de classement.
Conclusion
L’algorithme d’intelligence artificielle a correctement identifié 100 % des patients porteurs d’un rétrécissement aortique serré défini selon les recommandations actuelles. La mortalité à 5 ans est importante en cas de rétrécissement aortique serré, estimé à 67,9 %.
Pour aller plus loin :
Les approches non supervisées peuvent apporter une aide diagnostique majeure, d’autant plus dans le cadre d’une pathologie potentiellement sous-diagnostiquée comme le rétrécissement aortique.
Il est important de rappeler que l’association statistique ne signifie pas le lien de causalité. Il est possible que l’algorithme détermine des critères de sévérité sur des signes indirects au-delà des mesures directes de la valve aortique et finalement au-delà de la sévérité du rétrécissement aortique. Cette évaluation de l’algorithme pourrait finalement détecter la sévérité de la valve et aussi au travers des « cardiac damage » (Dilatation des cavités cardiaques, Fuite mitrale, altération de la FEVG…) qui sont de plus en plus établis comme des potentielles indications à une intervention.
Le biais majeur est le nombre de données manquantes (52 %). La qualité de la base de données est le fondement d’un bon algorithme, et représente souvent la principale limitation.
Enfin l’idéal serait de tester cette approche sur une autre base de données d’imagerie, afin d’apporter une validation externe robuste, nécessaire avant d’envisager toute application clinique.
Références bibliographiques
- Eveborn GW, Schirmer H, Heggelund G, Lunde P, Rasmussen K. The evolving epidemiology of valvular aortic stenosis. The Tromsø Study. Heart. 15 mars 2013;99(6):396‑400.
- Danielsen R, Aspelund T, Harris TB, Gudnason V. The prevalence of aortic stenosis in the elderly in Iceland and predictions for the coming decades: The AGES–Reykjavík study. Int J Cardiol. oct 2014;176(3):916‑22.
- Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al. Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery. N Engl J Med. 21 oct 2010;363(17):1597‑607.
- Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Rev Esp Cardiol Engl Ed. juin 2022;75(6):524.
- Shawn X Li. Trends in Utilization of Aortic Valve Replacement for Severe Aortic Stenosis.
Pour en savoir plus, consultez les hotlines complètes, en langue anglaise, présentées lors de l'ESC 2022 :
Toute l'actualité de l'ESC 2022
Ce compte rendu de l'ESC 2022 vous est proposé avec le soutien institutionnel de :
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio Online ou de la SFC, et n'engage pas leur responsabilité.
|
Dans la même thématique
Articles les plus lus

ECHO NET-RCT : L’intelligence artificielle fait mieux que l’écho standard pour évaluer la FEVG !
Publié le vendredi 26 août 2022
Amylose cardiaque : suivi échocardiographique, ECG, fibrillation auriculaire
Publié le mardi 5 juillet 2022
PROFID : l’IRM cardiaque améliore la prédiction du risque de mort subite en post-infarctus
Publié le lundi 18 avril 2022
Quand l'IRM permet de visualiser les dépôts fibrillaires myocardiques
Publié le lundi 20 juin 2022