3 minutes de lecture
Résultats de l’étude HELIOS-B: efficacité du Vutrisiran dans l’amylose cardiaque à ATTR
Publié le mardi 24 septembre 2024
En direct du congrès des JFIC-CAT 2024
Messages clés
- Le Vutrisiran est un traitement à ARN interférent qui bloque la synthèse hépatique de transthyrétine (TTR) utilisé actuellement dans le traitement de la polyneuropathie à ATTR héréditaire (ATTRv)
- Dans l’étude HELIOS-B, étude randomisée en double aveugle, l’utilisation de Vutrisiran chez les patients atteint de cardiomyopathie amyloïde à transthyrétine (ATTR-CM) était associée à une réduction de la mortalité toute cause et des récidives d'événements cardiovasculaires à 36 et 42 mois
- Il y avait également une amélioration de la capacité fonctionnelle, de la qualité de vie et des symptômes de l’insuffisance cardiaque
- Sa place dans l’arsenal thérapeutique et notamment son association ou non avec les stabilisateurs de la TTR (Tafamidis et Acoramidis) actuels traitements de référence reste à préciser
Introduction
L'amylose cardiaque à transthyrétine (ATTR-CM) est une maladie à l'origine de symptômes d’insuffisance cardiaque d’évolution progressive avec une survie diminuée et un choix thérapeutique restreint.
Le Vutrisiran, traitement à ARN interférent qui bloque la synthèse hépatique de TTR est approuvé pour le traitement de la polyneuropathie à TTR héréditaire. L’analyse préliminaire d’une sous population dans l’étude HELIOS-A avait permis de démontrer un potentiel effet bénéfique du Vutrisiran dans l’amélioration des symptômes cardiaques chez les patients atteints de polyneuropathie à ATTRv héréditaire.
L’objectif de cette étude était donc d’évaluer l’efficacité et la sécurité de l’utilisation du Vutrisiran dans la cardiomyopathie amyloïde à ATTR qu’elle soit sauvage (ATTRwt) ou héréditaire (ATTRv).
Méthodologie et résultats
Population de l’étude :
Les critères d’inclusion étaient: patients âgés entre 18 et 85 ans avec insuffisance cardiaque, critère échocardiographique d’amylose cardiaque à ATTR et preuve de dépôts amyloïdes à TTR (preuve histologique ou scintigraphie osseuse avec fixation cardiaque, sans gammapathie), qu’ils soient ou non été traités par Tafamidis.
Les critères d’exclusion étaient: un stade NYHA IV ou NYHA III avec stade 3 d’amylose suivant la classification du National Amyloid Center (NAC), polyneuropathie sévère, autre cause de cardiomyopathie, DFG < 30 ml/min.
Design :
Étude de phase 3, multicentrique, randomisée en double aveugle contre placebo, avec administration de Vutrisiran 25 mg ou de placebo en une injection sous-cutanée tous les 3 mois pour une durée totale de 36 mois, suivie d’une possibilité de poursuivre l’administration du Vutrisiran en ouvert pour une durée allant jusqu’à deux ans dans tous les bras (placebo compris).
Le critère d’évaluation principal était un critère composite de mortalité toutes causes et de récidive d'événements cardiovasculaires à 36 mois.
Les critères secondaires étaient la mortalité toutes causes à 42 mois (incluant 6 mois de phase ouverte), la variation à 30 mois de la distance parcourue au test de marche des 6 minutes, la variation du score au questionnaire cardiomyopathies de Kansas City (KCCQ-OS) et la variation de la classe NYHA.
Résultats :
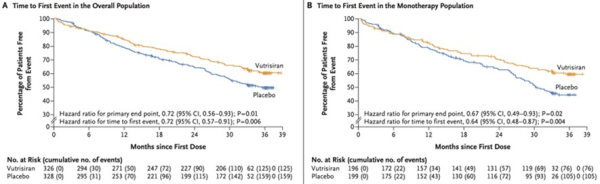
L’étude était positive sur l’ensemble des critères de jugements prédéfinis. Il y avait une réduction significative du critère de jugement principal dans le bras traité par Vutrisiran avec une réduction du risque relatif de 28% (HR = 0.72; IC 95%: 0.56-0.93; p=0.01).
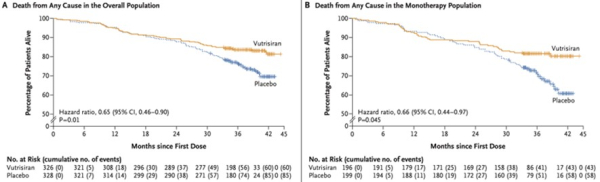
Concernant les critères secondaires, le Vutrisiran réduit significativement la mortalité toutes causes à 42 mois avec un risque relatif de 36% (HR= 0.65; IC 95%: 0.46-0.90; p = 0.01), améliore la capacité fonctionnelle au test de marche des 6 minutes (p<0.001), le score de qualité de vie (p<0.001) et le stade NYHA (p=0.02).
Ces résultats étaient concordants dans tous les sous-groupes préspécifiés (type d’amylose à TTR, NYHA, age à l’inclusion, patients traités ou non par Tafamidis).
Sécurité :
Il n’y avait pas de différence significative entre les deux groupes en termes d'événements indésirables.
Figure 1 : délai avant premier évènement dans la population totale (A) et dans la population sans Tafamidis (B)
Figure 2 : mortalité toute cause dans la population totale (A) et dans la population sans Tafamidis (B)
Conclusion
Chez les patients avec amylose cardiaque à ATTR-CM, le Vutrisiran réduit la mortalité toutes causes et les récidives d'événements cardiovasculaires, améliore la qualité de vie et la capacité fonctionnelle et prévient l’aggravation des symptômes d’IC, y compris chez les patients traités par Tafamidis.
Sa place dans l’arsenal thérapeutique et notamment son association ou non avec les stabilisateurs de la TTR, actuels traitements de référence, reste à préciser.
Références
1.Fontana M et al. Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy. N Engl J Med. 2024 Aug 30. doi: 10.1056/NEJMoa2409134. Epub ahead of print. PMID: 39213194.
Dans la même thématique
Articles les plus lus

Effets à long terme du patisiran : analyse post-hoc d'APOLLO-B et de la sous-population APOLLO OLE
Publié le mardi 24 septembre 2024
Comment évaluer et prévenir le risque de mort subite dans les CMH ?
Publié le mercredi 25 septembre 2024
Amylose cardiaque à transthyrétine et ARNi, quel impact à venir des résultats de l'étude HELIOS-B ?
Publié le mercredi 25 septembre 2024