4 minutes de lecture
Amylose cardiaque : pourquoi réaliser une IRM cardiaque ?
Publié le lundi 11 octobre 2021
Auteur :
Pr Patricia Réant
CHU de Bordeaux
Bien que non indispensable en systématique en cas de diagnostic très vraisemblable d’amylose cardiaque, l’IRM cardiaque est complémentaire de l’échocardiographie et de la scintigraphie en redressant parfois le diagnostic étiologique devant une CMH inexpliquée en apportant des informations en termes de caractérisation tissulaire mais aussi pour préciser le pronostic.
EN SAVOIR PLUS
L’imagerie par résonance magnétique (IRM) cardiaque renforce la sensibilité de l’échocardiographie pour affiner le diagnostic étiologique en cas de CMH, d’HVG inexpliquée ou limite. Elle permet tout d’abord une étude plus précise de la morphologie, des dimensions, de la masse et de la fonction systolique des ventricules que l’échocardiographie.
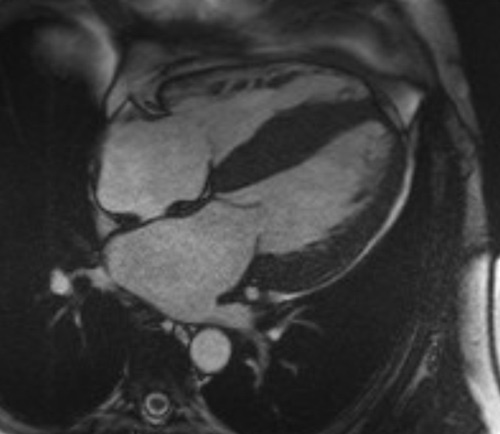
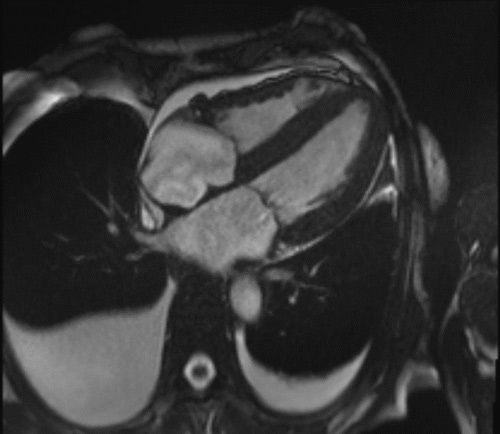
On retrouve généralement une hypertrophie VG diffuse, concentrique, une hypertrophie du VD, une dilatation biatriale, une infiltration des oreillettes, du septum inter-atrial et des feuillets valvulaires. Elle permet de quantifier précisément une dysfonction systolique ventriculaire gauche et droite éventuelle associée. Un épanchement péricardique et/ou pleural peut être également retrouvé, surtout en cas d’amylose cardiaque AL (Figure 5).
Figure 5 : Evaluation morphologique en IRM cardiaque en cas d’amylose cardiaque
5a : Patient avec amylose cardiaque TTR : hypertrophie VG diffuse, hypertrophie du SIA, dilatation biatriale
5b : Patient avec amylose cardiaque AL : hypertrophie biventriculaire, hypertrophie du SIA, dilatation bi atriale et épanchements péricardique et pleuraux
L’analyse des critères morphologiques en IRM en cas d’amylose cardiaque n’est cependant pas suffisante pour faire le diagnostic avec certitude d’amylose ou d’un autre diagnostic différentiel. D’après une étude récente, seulement 18% des patients avec amylose cardiaque confirmée présentent réellement une hypertrophie VG symétrique, alors que 55% des patients ont une hypertrophie VG asymétrique à prédominance septale, 24% une inversion de la courbure septale et 3% des patients n’ont aucune hypertrophie VG décelée à l’IRM.
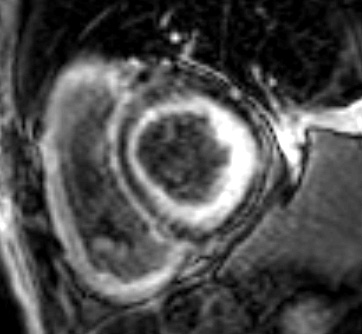
C’est la caractérisation tissulaire qui va permettre de révéler l’infiltration amyloïde caractéristique. Celle-ci va d’abord être suspectée devant un T1 natif myocardique augmenté (valeurs normales entre 950 ms et 1050 ms) en parallèle du volume extracellulaire myocardique (>30%). Cela sera éventuellement ensuite confirmé sur les séquences de rehaussements tardifs après injection de Gadolinium (Figure 6). Les rehaussements tardifs sont généralement très caractéristiques en cas d’amylose cardiaque ; les plus souvent, en « rails » au niveau du septum interventriculaire, ils vont généralement toucher non seulement le ventricule gauche, le ventricule droit mais aussi souvent le septum inter-atrial, les valves et les oreillettes, témoignant d’une atteinte globale du cœur par les dépôts amyloïdes.
Figure 6 : Rehaussements tardifs touchant typiquement les deux ventricules et débutant en sous-endocardiques avec un aspect caractéristique « en rails » du septum inter-ventriculaire en cas d’amylose cardiaque
Assez souvent, on note, lors de la réalisation de l’examen, des difficultés de réglage du temps d’inversion, cela doit d’autant plus faire suspecter le diagnostic d’amylose.
Les rehaussements tardifs en cas d’amylose sont circonférentiels, initialement sous-endocardiques et progressent en transmuralité avec la sévérité de l’infiltration. Le caractère transmural est un facteur pronostic péjoratif. En cas de forte suspicion d’amylose, l’absence de rehaussements ne permet pas d’éliminer complétement le diagnostic et il convient d’avoir recours à des biopsies. Enfin, la scintigraphie « amylose » est parfois plus sensible que l’IRM pour détecter une forme débutante d’amylose TTR.
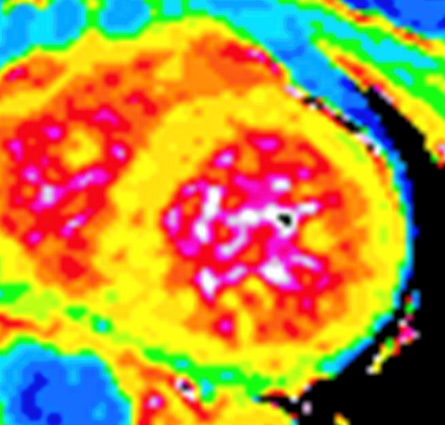
L’analyse du T1 mapping (Figure 7) et du volume extracellulaire myocardique (ECV) permettent une approche plus quantitative, plus reproductible, plus sensible et plus précoce que les rehaussements tardifs pour détecter l’atteinte cardiaque amyloïde.
Figure 7 : Cartographie de T1 mapping en IRM en cas d’amylose cardiaque
L’augmentation du T1 mapping natif myocardique (avant injection de gadolinium) est généralement >1100 ms en cas d’amylose cardiaque (normale entre 1000 et 1050 ms).
Le volume extracellulaire myocardique (ECV) calculé à l’aide des mesures de T1 avant et après injection de Gadolinium, couplés à un dosage récent de l’hématocrite du patient, est généralement élevé >30% en cas d’amylose cardiaque.
Il existe une valeur pronostique péjorative démontrée de l’ECV, au-delà de 45% en cas d’amylose AL et au-delà de 59% en cas d’amylose à TTR.
L’amylose cardiaque est une maladie souvent diagnostiquée trop tardivement. L’imagerie, et notamment l’échocardiographie, occupe une place importante dans le dépistage précoce de la maladie (couplée à la scintigraphie et au bilan immunologique) pour la mise en place le plus tôt possible d’une thérapeutique adaptée et pour le suivi des patients. Il faut rester prudent car une cartographie de strain longitudinal, une IRM cardiaque ou une scintigraphie amylose peu évocatrices n’excluent pas forcément le diagnostic.
Références :
- Martinez-Naharro A et al. Magnetic Resonance in Transthyretin Cardiac Amyloidosis. J Am Coll Cardiol 2017;70:466–77.
- Vogelsberg H. et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008;10:1022-1030.
- Syed IS et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis J Am Coll Cardiol Cardiovasc Imaging 2010;3:155-164.
- Martinez-Naharro A et al. Native T1 and Extracellular Volume in Transthyretin Amyloidosis. J Am Coll Cardiol Cardiovasc Imaging 2019;12:810-819.
- Banypersad S et al. T1 mapping and survival in systemic light-chain amyloidosis. Eur H journal 2015 ;36 :244-51.
- Gillmore JD. et al. Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation 2016;133:2404-2412.
Retrouvez l'intégralité du dossier spécial "Prise en charge de l'amylose cardiaque en 2021"
Ce contenu vous est proposé avec le soutien institutionnel de Pfizer Maladies Rares