Perspectives sur la prise en charge de la mort subite chez le patient en post infarctus
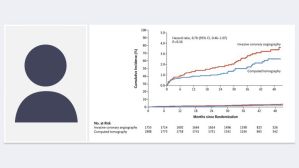
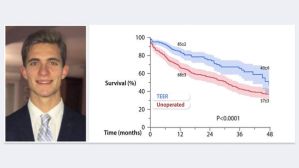
La survenue de TV/FV sous LifeVest durant la période précoce post-infarctus est associée à un risque significatif de récidive et de décès à 1 an sous DAI, montre l’étude WICD-MI.
Publié le lundi 3 mars 2025