5 minutes de lecture
HELIOS-B : le vutrisiran, un nouveau à ARN-interférent traitement efficace dans l'amylose cardiaque à transthyrétine
Publié le samedi 31 août 2024
En direct du congrès de l'ESC 2024
Après le Tafamidis et l'Acoramidis, le Vutrisiran, nouvelle révolution dans l'amylose cardiaque à transthyrétine. D’après “Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy, HELIOS-B study” présentée à l’ESC 2024.
Messages clés
- Le Vutrisiran, un traitement à ARN interférent, bloque la synthèse hépatique de transthyrétine (TTR) et son usage était jusqu'à présent réservé à la polyneuropathie associée à l'amylose à TTR.
- Dans un essai randomisé en double aveugle, le Vutrisiran a démontré une efficacité contre placebo sur la réduction d'un critère composite comprenant mortalité toute cause et récurrence d'évènements cardiovasculaires.
- L'étude est également positive sur des critères fonctionnels et de qualité de vie avec un bon profil de tolérance.
- Amélioration pronostique dans l'ensemble de la population (40% de patients étaient sous Tafamidis) et chez les patients sans autre traitement spécifique.
- Ce nouveau traitement efficace a une action complémentaire avec les stabilisateurs de la TTR (Tafamidis et Acoramidis) bien que l’association n’ait pas clairement été testée pour voir s’il y avait une efficacité plus importante de la bithérapie versus la monothérapie et constitue une arme de plus dans la prise en charge de cette pathologie.
Introduction
L'amylose cardiaque à transthyrétine (TTR) concernerait jusqu’à 20% des patients avec insuffisance cardiaque à fraction d'éjection préservée et 16% des patients avec rétrécissement aortique serré.
Elle peut être de forme héréditaire (génétique) ou sauvage.
Bien qu'elle soit associée à un pronostic sombre, le Tafamidis1 puis l'Acoramidis2, deux traitements avec effet stabilisateur sur la dégradation de la TTR, ont démontré une amélioration significative du pronostic.
Le Vutrisiran un traitement à ARN interférent, bloque la synthèse hépatique de TTR. C’est un traitement qui s’injecte de façon sous-cutanée tous les 3 mois. Son usage était jusqu'à maintenant réservé à la polyneuropathie associée à l'amylose à TTR. Des données exploratoires ont permis d'identifier un possible bénéfice à l'atteinte cardiaque spécifique de la TTR3 et il pourrait exister une synergie d'effet avec les traitements stabilisateurs.
L'objectif de cette étude était donc d'évaluer l'efficacité et la sécurité de l'utilisation de Vutrisiran dans l'amylose cardiaque à TTR.
Méthodologie et résultats
Population de l'étude :
Critères d'inclusion : Âge entre 18 et 85 ans, diagnostic d'amylose cardiaque à TTR génétique ou sauvage (preuve histologique ou scintigraphie osseuse avec fixation cardiaque sans gammapathie), épaisseur septale en ETT supérieure à 12 mm, au moins une hospitalisation pour insuffisance cardiaque ou signe clinique d'insuffisance cardiaque, NT-proBNP > 300 pg/mL et < 8500 pg/mL et distance de marche de 6 min > 150 m. Traitement possible par Tafamidis au moment de l'inclusion.
Critères d'exclusion : NYHA 4 ou NYHA 3 avec stade 3 d'amylose, polyneuropathie sévère, autre cause de cardiomyopathie, DFG < 30 mL/min/m2.
Design :
Étude de phase 3, multicentrique, internationale, randomisée, en double aveugle contre placebo.
Randomisation 1:1 avec Vutrisiran 25 mg ou un placebo en sous-cutané toutes les 12 semaines pendant 36 mois.
Randomisation sur le type d'amylose à TTR, NYHA, l'âge à l'inclusion et sur l'usage de Tafamidis.
Introduction possible de Tafamidis après inclusion. A la fin du protocole possibilité de participer à une extension en ouvert de l'étude avec prise de Vutrisiran pour l'ensemble des patients.
Critères de jugement : Évaluation de l'ensemble des critères de jugement dans l'ensemble de la population et chez les patients ne prenant pas de Tafamidis.
Primaire : Composite de mortalité toute cause et récurrence d'évènement cardiovasculaire (hospitalisation pour une cause cardiovasculaire ou une consultation urgente pour insuffisance cardiaque) à 36 mois.
Secondaire : Mortalité toute cause à 42 mois, changement à 30 mois : i) du test de marche de 6 minutes, ii) du score de qualité de vie (questionnaire de cardiomyopathies de Kansas City), iii) NYHA. Critères de sécurité.
Résultats :
Population totale :
- Inclusion de 655 patients
- 326 dans le groupe Vutrisiran, âge médian 77 ans, 92% d'hommes
- 329 dans le groupe placebo, âge médian 76 ans, 93% d'hommes
- 40% de patient sous Tafamidis à l'inclusion
- 90% de forme sauvage d'amylose à TTR
Population sans Tafamidis : 196 dans le groupe Vutrisiran et 199 dans le groupe placebo.
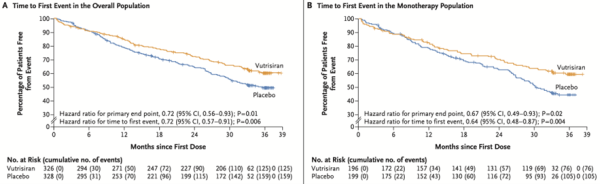
L'étude était positive sur l'ensemble des critères de jugement prédéfinis. Le traitement par Vutrisiran était associé à une réduction significative du critère de jugement principal (Figure 1) dans la population totale (HR=0,72 ; intervalle de confiance [IC] à 95% : 0,56-0,93 ; P=0,01) et dans la population ne prenant pas de Tafamidis (HR=0,67 ; 95% IC : 0,49-0,93 ; P=0,02).
Il faut néanmoins du temps pour que le traitement démontre son efficacité ce qui est lié à son mécanisme d’action, avec une différence qui apparaît plus significative à partir de 1 an de traitement.
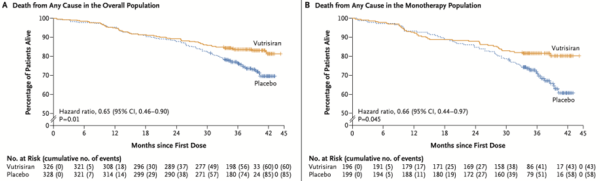
La prise de Vutrisiran réduisait significativement la mortalité toute cause (Figure 2) à 42 mois (HR=0,65 ; 95% IC : 0,46-0,90 ; P=0,01) ainsi que l'altération du test de marche de 6 minutes (P<0,001) et du score de qualité de vie (P<0,001). Il y avait également une amélioration de la NYHA (P=0,02).
À noter que dans le sous-groupe de patient sous Tafamidis initialement, il n'y avait pas de différence significative sur le critère de jugement principal et sur la mortalité toute cause.
Sécurité :
Il n'y avait pas de différence significative entre les 2 groupes concernant la survenue d'évènement indésirable (59% d'évènement indésirable grave dans le groupe placebo contre 49% dans le groupe Vutrisiran).
Figure 1 : mortalité toute cause dans la population totale (A) et dans la population sans Tafamidis (B)4
Figure 2 : mortalité toute cause dans la population totale (A) et dans la population sans Tafamidis (B)4
Conclusion
L'étude HELIOS-B met donc en évidence une amélioration significative de la survie chez les patients avec amylose cardiaque à TTR grâce à l'usage d'un traitement diminuant la synthèse hépatique de TTR, le Vutrisiran. Cette amélioration a été mise en évidence avec ou sans la prise concomitante de Tafamidis.
Par son mécanisme ce traitement peut être un traitement efficace et possiblement complémentaire des traitements spécifiques déjà validés dans cette indication.
En plus de ces résultats spectaculaires, il faut noter la nette amélioration du pronostic de ces patients depuis la première étude ayant validé le Tafamidis publiée en 2018 avec une survie à 30 mois passée de 70% à 85% dans le bras traitement.
Au vu de l'absence d'amélioration pronostique significative dans le sous-groupe de patients déjà traités par Tafamidis se pose la question de l'intérêt supplémentaire du Vutrisiran et de la place de ce traitement dans la prise en charge de l'amylose à TTR. Des études randomisées complémentaires pourraient être menées pour évaluer l’efficacité d’une monothérapie versus bithérapie.
Références
1. Maurer MS, Schwartz JH, Gundapaneni B, Elliott PM, Merlini G, Waddington-Cruz M, et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 2018 Sep 13;379(11):1007–16.
2. Gillmore JD, Judge DP, Cappelli F, Fontana M, Garcia-Pavia P, Gibbs S, et al. Efficacy and Safety of Acoramidis in Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 2024 Jan 11;390(2):132–42.
3. Garcia-Pavia P, Grogan M, Kale P, Berk JL, Maurer MS, Conceição I, et al. Impact of vutrisiran on exploratory cardiac parameters in hereditary transthyretin-mediated amyloidosis with polyneuropathy. Eur J Heart Fail. 2024 Feb;26(2):397–410.
4. Fontana M, Berk JL, Gillmore JD, Witteles RM, Grogan M, Drachman B, et al. Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy. N Engl J Med [Internet]. [cited 2024 Aug 30];0(0). Available from: https://www.nejm.org/doi/full/10.1056/NEJMoa2409134
Dans la même thématique
Articles les plus lus

CASTLE-HTx : persistance du bénéfice de l’ablation de FA chez les patients avec IC avancée – résultats à 2 ans
Publié le samedi 31 août 2024
L’essentiel de l’ESC 2024 vu par la SFC : focus sur HELIOS-B
Publié le vendredi 11 octobre 2024
Vutrisiran dans l’ATTR avec cardiomyopathie : ce qu’il faut retenir de l’étude HELIOS-B à l’ESC 2024
Publié le samedi 31 août 2024
L’actualité de l’ESC 2024 vue par la présidente du Groupe Insuffisance Cardiaque et Cardiomyopathies
Publié le mardi 3 septembre 2024