12 minutes de lecture
Syndrome de Tako-Tsubo : recommandations/consensus ESC 2018
Publié le mardi 5 février 2019
Cet article vous est proposé par Antonin Trimaille, interne en cardiologie à Strasbourg, avec la relecture de Théo Pezel, interne en cardiologie à Paris, tous deux membre du Collège des Cardiologues en Formation (CCF).
Le syndrome de Tako-Tsubo est une pathologie que le cardiologue sera amené à rencontrer à plusieurs reprises au cours de sa carrière. Sa prise en charge reste néanmoins relativement méconnue et peu codifiée. La Société Européenne de Cardiologie a donc décidé de mettre au point un consensus international d’experts en 2018 1,2.
Historique
Hikaru Sato a été le premier en 1990, à décrire le syndrome de Tako-Tsubo (TTS) en rapportant dans une revue médicale japonaise une série de 5 cas de patients présentant une douleur thoracique avec modifications électrocardiographiques typiques d’un infarctus du myocarde mais avec coronarographie normale et troubles de la cinétique pariétale atypiques à l’échocardiographie3. Durant plusieurs années, ce syndrome a été considéré comme touchant spécifiquement les asiatiques, jusqu’à que les premières équipes françaises et américaines publient leurs premiers cas chez des patients caucasiens à la fin des années 90.
Le TTS tire son nom des pièges à poulpe utilisés jadis au Japon et dont la forme rappelle l’aspect ventriculographique du ventricule gauche en systole du fait des troubles de cinétique typiquement rencontrés dans cette maladie. D’autres termes sont utilisés pour parler du TTS tels que « cardiomyopathie de stress », « syndrome de ballonisation apicale » ou encore « syndrome du cœur brisé ».
Epidémiologie
Le TTS représente 1 à 3 % des patients avec suspicion de syndrome coronaire aigu. Cette proportion augmente jusqu’à 5 à 6 % dans une population uniquement féminine.
Environ 90 % des TTS concerne des femmes avec un âge moyen de 67 à 70 ans. Une femme de plus de 55 ans a 5 fois plus de risque de développer un TTS qu’une femme plus jeune, et 10 fois plus qu’un homme4.
Physiopathologie
Mécanismes du TTS
Les mécanismes physiopathologiques précis du TTS ne sont pas encore complètement élucidés.
Néanmoins, plusieurs études ont montré le rôle central du système nerveux sympathique qui, à l’occasion d’un facteur déclenchant émotionnel, physique ou combiné, déverse un excès de catécholamines à l’origine des troubles de cinétique myocardique5.
Le mécanisme par lequel les catécholamines entraînent ces anomalies de contraction n’est pas clairement connu actuellement. Plusieurs hypothèses font l’objet de recherche : spasme coronaire épicardique, dysfonction microcirculatoire, toxicité des catécholamines sur les cardiomyocytes, activation et inhibition des voies de survie cardiomyocytaire.
Facteurs déclenchants
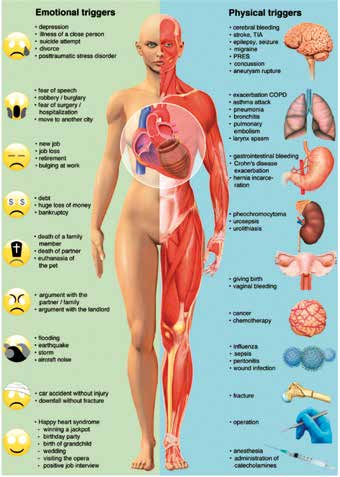
De nombreux facteurs déclenchants émotionnels et physiques ont été identifiés comme participant à la survenue d’un TTS. Ils sont résumés dans la figure 1.
Facteurs prédisposants
Les facteurs déclenchants décrits précédemment peuvent potentiellement toucher n’importe quel individu au cours de sa vie. Pourtant, une partie seulement des patients exposés à de tels événements vont développer un TTS. Certains en présenteront même à plusieurs reprises. Ce constat est en faveur de l’existence de facteurs de risque prédisposant à la survenue d’un TTS.
La nette prépondérance épidémiologique des femmes en âge post-ménopausique suggère une influence hormonale dans la genèse d’un TTS. Bien que des données montrant clairement un lien direct entre le taux d’œstrogènes et le développement d’un TTS manquent, plusieurs mécanismes physiopathologiques sont envisagés. Ainsi, il est établi que les œstrogènes influencent le tonus vasomoteur en régulant la production endothéliale de NO. Ils sont également capables d’une atténuation de la vasoconstriction liée aux catécholamines.
Figure 1. Facteurs déclenchants de TTS1.
L’existence d’un support génétique au TTS est également suspectée devant l’existence de cas groupés au sein d’une même famille. Il ne s’agit probablement pas de la mutation de séquence d’un gène unique mais bien de l’interaction entre des facteurs environnementaux et un polymorphisme génétique touchant en particulier les gènes codant les récepteurs adrénergiques.
Enfin, une importante prévalence de troubles psychiatriques et/ou neurologiques a été identifiée au sein des cohortes de patients atteints de TTS.
Chronobiologie
Malgré des données contradictoires, il semble que la prévalence de TTS est plus importante les mois d’été et plus fréquemment le lundi.
Formes de TTS
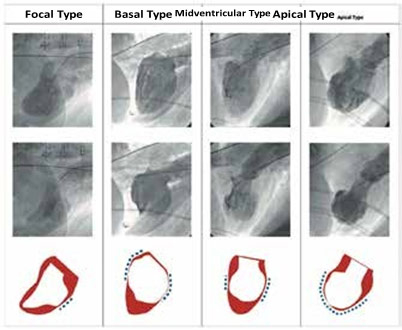
Quatre formes de TTS sont décrites en fonction de la distribution myocardique des troubles de cinétique (figure 2). La forme apicale est la plus fréquente et correspond au syndrome de ballonisation apicale. Plus rarement, il est rencontré des TTS médioventriculaire, basal ou focal.
A côté de ces quatre formes principales, il a également été décrit des TTS biventriculaires, isolés au ventricule droit ou avec hypokinésie globale. Cette dernière est difficile à mettre en relation en première intention avec un TTS du fait de la multitude de diagnostics différentiels possibles.
Il est à noter que le ventricule droit est atteint dans un tiers des cas et qu’il s’agit d’un facteur de mauvais pronostic.
Figure 2. Formes de TTS1.
Diagnostic
Critères diagnostics
La difficulté dans le diagnostic de TTS repose sur sa très grande proximité avec son principal diagnostic différentiel, le syndrome coronaire aigu (SCA). Dans l’objectif d’en simplifier la détection, plusieurs critères diagnostics ont été proposés depuis. L’ESC propose dans son consensus une mise à jour avec introduction des critères interTAK (tableau 1). Les principaux changements par rapport aux critères précédents sont les suivants :
- Le phéochromocytome n’est désormais plus exclu du diagnostic de TTS ;
- La présence d’une atteinte coronaire objectivée à la coronarographie n’est plus en contradiction avec le diagnostic de TTS ;
- La possibilité de rares cas de trouble de cinétique dans un territoire artériel (TTS focal, cf. infra).
Critères diagnostiques internationaux de TTS (critères interTAK)
- Dysfonction ventriculaire gauche transitoire (hypokinésie, akinésie ou dyskinésie) avec ballonisation apicale ou troubles de cinétique médians, basaux ou focaux. Une atteinte ventriculaire droite peut être associée. Ces troubles de cinétique pariétale transitoires dépassent en général un territoire de systématisation vasculaire ; toutefois, de rares cas peuvent exister avec atteinte d’un territoire artériel (TTS focal).
- Un facteur déclenchant émotionnel, physique ou combiné peut précéder la survenue du TTS.
- Des troubles neurologiques (hémorragies sous-arachnoïdiennes, AVC, AIT, etc.) ou un phéochromocytome peuvent être des facteurs déclenchants de TTS.
- Des modifications de l’ECG sont présentes (sus- ou sous-décalage du segment ST, inversion des ondes T, prolongation de l’intervalle QTc). Toutefois, il existe des cas sans modification ECG.
- Les biomarqueurs cardiaques (troponine et CK) sont modérément augmentés.
Une élévation significative du BNP est fréquente. - Une atteinte coronarienne significative n’est pas en contradiction avec un TTS.
- Il n’existe pas d’argument en faveur d’une myocardite.
- Les femmes après la ménopause sont principalement touchées.
Clinique
Dans la plupart des cas, la présentation initiale est une douleur thoracique, une dyspnée ou une syncope. Parfois, le TTS est diagnostiqué devant la découverte fortuite de modifications ECG ou une élévation des biomarqueurs cardiaques.
Il est intéressant de noter que les patients avec un facteur déclenchant physique, en particulier d’origine neurologique, ont des symptômes de TTS le plus souvent peu marqués, à l’inverse de ceux avec un facteur déclenchant émotionnel chez qui le tableau sera plus bruyant (douleur thoracique et palpitations en particulier).
Electrocardiogramme
L’ECG initial est anormal dans la plupart des cas. Le plus souvent, il montre un sus-décalage du segment ST et/ou des ondes T négatives. Comme dans un SCA, le territoire des anomalies ECG correspond aux segments myocardiques touchés. La plupart du temps, elles sont donc retrouvées dans le territoire antéro-septo-apical, mimant ainsi un infarctus antérieur.
A l’image d’un SCA, l’ECG d’un patient atteint de TTS évolue dans le temps avec le plus souvent la résolution du sus-décalage du segment ST et l’apparition progressive d’ondes T négatives et d’un allongement de l’espace QT durant les premiers jours, puis la résolution de ces anomalies au cours des semaines suivantes.
D’autres anomalies ECG plus rarement rencontrées ont été décrites. Il peut s’agir d’ondes Q antérieures qui régresseront progressivement au cours du temps, de QRS fragmentés ou encore d’un microvoltage en rapport avec l’œdème myocardique. L’apparition d’un bloc de branche gauche a été retrouvée chez 5 % des TTS du registre InterTAK. Enfin, la présence d’un sous-décalage du segment ST est rare et reste davantage en faveur d’un SCA.
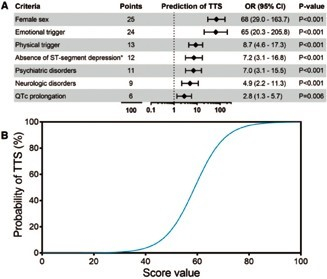
Score diagnostique InterTAK
Le score diagnostique InterTAK (figure 3) a été développé afin d’aider les cliniciens à distinguer SCA et TTS et pour prédire la probabilité de présence d’un TTS6. Il comprend 7 paramètres cliniques et électrocardiographiques qui peuvent donc être recueillis facilement dès l’admission aux Urgences. Il s’agit d’un score continu avec un total maximal de 100 points. Un score de 30 points représente une probabilité de TTS inférieur à 1 % et un score de 70 points correspond à une probabilité de TTS d’environ 90 %.
Biologie
La troponine est augmentée à l’admission mais présentera un pic faible. Le BNP et le NT-proBNP sont significativement élevés comme reflet de la dysfonction myocardique régionale. Il existe donc une dissociation entre la troponine faiblement augmentée et le BNP fortement élevé.
De nouveaux biomarqueurs font l’objet de recherches afin d’apporter une aide à la distinction entre TTS et SCA mais ne sont pas actuellement utilisés en routine (IL-6, microRNA circulants, cytokines).
Imagerie
La coronarographie doit être réalisée en urgence devant un sus-décalage du segment ST. L’absence de lésion coronaire associée à des troubles de cinétique typiques à la ventriculographie posent le diagnostic de TTS. Néanmoins, comme vu précédemment, la présence d’une atteinte coronarienne significative n’exclut plus le diagnostic de TTS. Dans ce cas, il faut comparer les artères lésées et les territoires myocardiques dont la cinétique est diminuée, à la recherche d’un mis-match entre la perfusion et la contraction. Le signe du « téton apical » peut être particulièrement intéressant dans cette situation. En effet, dans le TTS apical typique, la partie toute distale de l’apex garde souvent une contraction conservée contrastant avec le reste de l’apex hypokinétique voire akinétique.
L’échocardiographie transthoracique permet l’analyse des segments myocardiques atteints et l’évaluation de la fonction ventriculaire gauche globale. Les troubles de cinétique s’étendent au-delà des territoires de systématisation coronaire et apparaissent circulaires au strain. En cas d’atteinte ventriculaire droite, une dilatation est le plus souvent observée avec hypokinésie ou akinésie de la paroi libre et de l’apex.
L’IRM ne peut pas être réalisée à la phase aiguë dans la plupart des centres. Elle garde un intérêt à la phase subaiguë puisqu’elle permet, en plus de l’évaluation de la fonction ventriculaire, l’analyse de la paroi myocardique et la recherche d’œdème, d’inflammation ou de nécrose.
Figure 3. Score InterTAK2.
Enfin, l’imagerie nucléaire apporte également de nombreuses informations concernant l’évaluation de la perfusion, du métabolisme et de l’innervation coronarienne.
Algorithme diagnostique
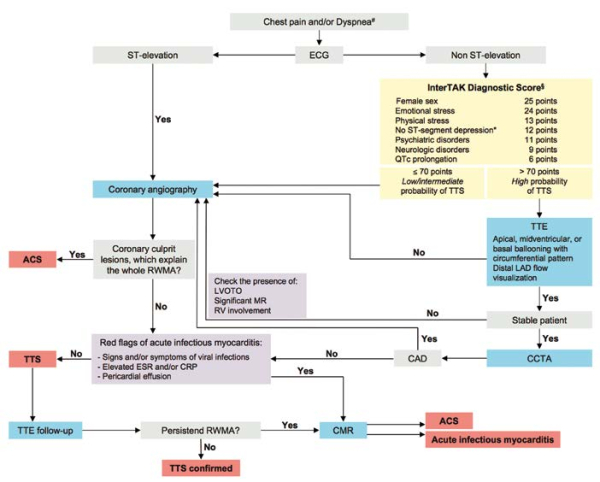
En intégrant toutes ces données, les experts de l’ESC ont proposé un algorithme de prise en charge diagnostique du TTS (figure 4).
Devant une douleur thoracique et/ou une dyspnée, tout patient avec un sus-décalage du segment ST doit bénéficier en urgence d’une coronarographie. En l’absence de sus-décalage, la suspicion de TTS doit mener au calcul du score InterTAK. Si celui-ci retrouve une probabilité faible ou intermédiaire de TTS (≤ 70 points), une coronarographie doit être réalisée. En présence d’une probabilité forte (> 70 points), l’échocardiographie peut être réalisée en première intention. En présence des anomalies de cinétique typiques du TTS chez un patient stable, un coroscanner pourra être programmé afin d’éliminer une maladie coronaire. En l’absence d’atteinte coronarienne, la recherche de signes de myocardite doit être systématique (virose, augmentation de la CRP, épanchement péricardique). Au moindre doute, une IRM cardiaque devra être demandée.
Figure 4. Algorithme diagnostique du TTS2.
Complications
Bien que le TTS soit une pathologie par essence réversible, l’instabilité hémodynamique et électrophysiologique qu’elle entraine à la phase aigüe expose les patients qui en sont victimes à des complications potentiellement graves. Un trigger physique, une pathologie neurologique ou psychiatrique aigüe, un taux de troponine supérieur à 10 fois la normale ou encore une FEVG altérée sont des facteurs de mauvais pronostic. Les hommes sont également plus à risque d’évolution défavorable.
Au plan hémodynamique, les complications les plus fréquentes sont l’insuffisance cardiaque aigüe qui peut aller jusqu’au choc cardiogénique. Dans la forme apicale, l’hyperkinésie des segments basaux peut être à l’origine d’une obstruction dynamique de la chambre de chasse ventriculaire gauche (LVOTO)7,8, en particulier chez les patients avec bourrelet septal préexistant. L’apparition d’un gradient intra-ventriculaire gauche peut aussi être à l’origine d’une insuffisance mitrale par mouvement antérieur de la valve mitrale antérieure (SAM). Une insuffisance mitrale est ainsi présente chez 15 à 25 % des patients atteints de TTS.
Au plan rythmique, les troubles du rythme ont un impact important dans l’évolution à court terme9. Les troubles du rythme graves (torsade de pointe, tachycardie ventriculaire, fibrillation ventriculaire) sur-viennent dans 3 à 8 % des cas et sont une des causes principales de décès dans le TTS. Ils surviennent plus fréquemment à la phase toute aigüe du TTS c’est-à-dire dans les premiers jours et coïncident avec une négativation des ondes T dans le territoire antéro-latéral et avec l’allongement de l’espace QT.
L’espace QT est un déterminant important dans la genèse des troubles du rythme ventriculaire, en particulier quand il excède 500 msec. Des études en IRM ont montré que l’allongement de l’espace QT était en relation avec l’œdème myocardique, lui-même pouvant favoriser les troubles du rythme.
L’existence d’une hypokinésie voire d’une akinésie myocardique peut favoriser la formation d’un thrombus intra-ventriculaire, à risque d’embolisation périphérique.
La récidive de TTS survient dans environ 5 % des cas, le plus souvent entre 3 semaines et 3 ans après le premier épisode. Le facteur déclenchant et la forme du TTS peuvent différer entre deux épisodes10.
Traitements
Du fait de son principal diagnostic différentiel, le syndrome coronaire aigu, un patient victime d’un TTS doit être hospitalisé dans une structure comprenant une salle de cathétérisme.
Il pourra pour la même raison recevoir avant la coronarographie les traitements recommandés pour un SCA.
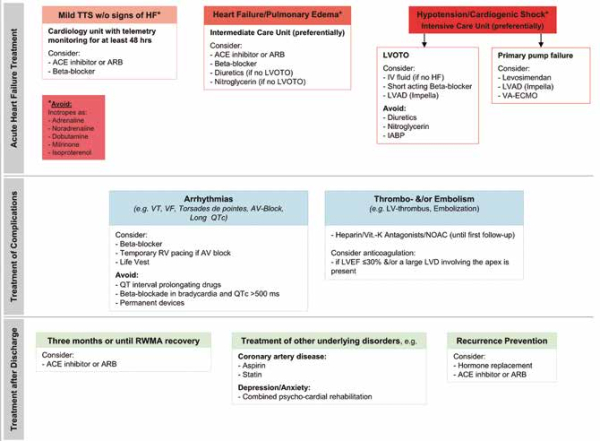
La suite du traitement dépend de la gravité de l’atteinte (figure 5).
Choc cardiogénique
Le patient doit être hospitalisé en Réanimation ou en Soins Intensifs. Il faut rapidement rechercher la présence d’une LVOTO par la recherche d’un gradient de pression intra-ventriculaire gauche en coronarographie ou en échocardiographie.
En présence d’une LVOTO, l’administration de catécholamines peut être à l’origine d’une aggravation de l’obstruction. Dans ce cas, le Levosimendan peut être une alternative intéressante car il semble avoir une efficacité et une tolérance satisfaisantes dans cette population de patients. Les bétabloquants peuvent améliorer l’obstruction intraventriculaire gauche mais restent contre-indiqués à la phase aiguë d’un état de choc. Afin de ne pas aggraver l’obstruction, il faudra ne pas avoir recours aux diurétiques, aux vasodilatateurs (dérivés nitrés) ou à une contre-pulsion intra-aortique.
De manière générale dans le TTS, l’utilisation des catécholamines doit être éviter car elle semble aggraver les troubles de la cinétique myocardique.
Dans les atteintes très sévères, l’utilisation de dispositifs d’assistance ventriculaire temporaires tels qu’une ECMO veino-artérielle ou une Impella peut permettre d’attendre une récupération de la fonction cardiaque.
Insuffisance cardiaque
Dans les formes moins graves d’insuffisance cardiaque, l’utilisation de bétabloquants semblent apporter un bénéfice pour accélérer la récupération de la FEVG dans des modèles animaux, même si les données cliniques supportant leur utilisation manquent à l’heure actuelle. Par ailleurs, il faut les utiliser avec grande précaution en cas d’intervalle QT allongé.
Les inhibiteurs de l’enzyme de conversion (IEC) et les antagonistes des récepteurs de l’angiotensine 2 (ARA2) semblent également aider à la récupération de la FEVG.
Complications thrombo-emboliques
En présence d’une hypokinésie ou akinésie sévère, une anticoagulation curative doit être discutée.
Complications rythmiques
L’utilisation de traitements allongeant l’intervalle QT doit se faire avec prudence.
Du fait du caractère réversible du TTS, l’implantation d’un défibrillateur automatique en prévention secondaire d’un trouble du rythme ventriculaire grave n’a pas d’utilité prouvée et doit donc se décider au cas par cas. En cas d’atteinte sévère avec un intervalle QT très allongé, le port d’une LifeVest peut être discuté le temps de la récupération.
Figure 5. Algorithme thérapeutique du TTS2.
Traitements à long terme
L’utilisation d’IEC ou d’ARAII au long cours est associée à une amélioration de la survie à 1 an dans une étude5. Ils semblent également diminuer la récidive.
A l’inverse, nous ne disposons pas de données sur la survie avec les bétabloquants.
Si une maladie coronaire est associée, il est recommandé de prescrire de l’aspirine et une statine.
Enfin, le traitement des facteurs déclenchants et prédisposants est primordial. En cas de pathologie psychiatrique, une réhabilitation combinée cardio-psychiatrique sera utile.
Références bibliographiques
- Jelena-Rima Ghadri and al. International Expert Consensus Document on Takotsubo Syndrome (Part I): Clinical Characteristics, Diagnostic Criteria, and Pathophysiology, European Heart Journal, Volume 39, Issue 22, 7 June 2018, Pages 2032–2046
- Jelena-Rima Ghadri and al. International Expert Consensus Document on Takotsubo Syndrome (Part II): Diagnostic Workup, Outcome, and Management, European Heart Journal, Volume 39, Issue 22, 7 June 2018, Pages 2047–2062
- Sato H. Tako-Tsubo-like left ventricular dysfunction due to multivessel coronary spasm. In: K Kodama, K, Haze M Hori, eds. Clinical Aspect of Myocardial Injury : From Ischemia to Heart Failure. Tokyo: Kagakuhyoronsha
- Deshmukh A, Kumar G, Pant S, Rihal C, Murugiah K, Mehta JL. Prevalence of Takotsubo cardiomyopathy in the United States. Am Heart J 2012;164: 66–71 e1
- Templin C. et al. Clinical Features and Outcomes of Takotsubo (Stress) Cardiomyopathy. N Engl J Med 2015;373:929–938
- Ghadri, J. and al. A novel clinical score (InterTAK Diagnostic Score) to differentiate takotsubo syndrome from acute coronary syndrome: results from the International Takotsubo Registry. Eur J Heart Fail, 19: 1036-1042
Dans la même thématique
Articles les plus lus

Choc électrique et FA : Il faut taper fort d'entrée de jeu ! Analyse détaillée.
Publié le 31 août 2019