25 minutes de lecture
Guidelines ESC 2022 : Prise en Charge des Arythmies Ventriculaires et Prévention de la Mort Subite
Publié le jeudi 25 août 2022
En direct de l'ESC Congress 2022
Ces recommandations 2022, qui actualisent les précédentes, datant de 2015, ont été conçues pour être pragmatiques et faciliter la prise en charge des patients par les cliniciens. Elles font la part belle au rôle de la génétique et de l'imagerie avec en particulier l’IRM cardiaque. Les indications d’ablation progressent également dans différentes cardiopathies.
Les 10 key-messages de ces recommandations
- Ces recommandations insistent sur la nécessité de former la population générale aux techniques de premiers secours et promeuvent le déploiement des applications smartphones permettant à tout citoyen volontaire formé à ces techniques d’être alerté et d’intervenir en cas d'ACR extrahospitalier à proximité.
- Un nouvel algorithme systématique et pragmatique, étape par étape, sur le management de la mort subite, précise qu’il n’y pas d’indication à une coronarographie en urgence en dehors du sus-ST, et prévoit la réalisation d’un scanner thoracique et cérébral en l’absence de cause extracardiaque évidente, ainsi que la réalisation et la conservation des prélèvements génétiques et toxicologiques. Ces recommandations encouragent la réalisation de plus d’autopsies compréhensives dans ce contexte ; qui sont rarement aussi utilisées qu’elles le devraient.
- L’IRM a une place fondamentale dans ces recommandations, dont ses indications sont précisées, tant dans le cadre du bilan étiologique, que pour guider les indications à l’implantation de DAI, notamment en présence de rehaussement tardif significatif.
- Le poids de la génétique est très important dans ces guidelines, qui élargissent et précisent la place du conseil et des tests génétiques dans les situations de mort subite et dans les maladies associées à la mort subite.
- Une éviction de l'activité physique de haute intensité est préconisée en cas de cardiomyopathie dilatée ou non dilatée hypokinétique, et chez les porteurs de la mutation LMNA, en cas de DAVD. Elle doit probablement l'être également chez les porteurs de mutations associées à la DAVD. En revanche, dans la CMH, l’activité physique reste possible en l’absence de marqueurs de risque particuliers.
- Chez les patients coronariens avec une FEVG entre 36 et 40 %, et qui font de la TVNS ou des syncopes inexpliquées, la réalisation d’une stimulation ventriculaire programmée peut guider l’implantation d’un DAI en cas de positivité, tandis qu’un holter implantable longue durée sera proposé en cas de négativité. Dans ces situations ischémiques, la place de la SVP est renforcée, mais aussi des procédures ablatives, puisqu’en cas de TV soutenue symptomatique et récidivante, elles privilégient l’ablation à une escalade des antiarythmiques, et qu’en cas de FEVG > 40 %, l’ablation peut permettre désormais de surseoir à l’implantation d’un DAI dans certains cas.
- Le traitement conventionnel de l’insuffisance cardiaque (incluant bétabloquant, ARM, IEC/Entresto, iSGLT2 à dose optimale) reste la pierre angulaire du traitement préventif de la mort subite chez les patients avec FEVG altérée.
- Chez les patients avec une cardiomyopathie dilatée ou non dilatée hypokinétique à FEVG < 50 %, il faut rechercher des FDR de mort subite (syncope, rehaussement tardif, stimulation ventriculaire programmée et certaines mutations) pour poser l’indication à un DAI, si au moins 2 FDR sont retrouvés.
- Ces recommandations éclaircissent la prise en charge rythmologique de la sarcoïdose cardiaque, et si l’implantation d’un DAI reste indiquée en cas de FEVG < 35 %, elle devient aussi possible devant un rehaussement tardif significatif à l’IRM, alors que nous irons d’abord à la stimulation ventriculaire programmée devant un rehaussement tardif minime, si la FEVG est entre 35 et 50 %. Dans ce cas précis, le DAI sera implanté en cas de positivité de la SVP.
- En ce qui concerne les maladies électriques primaires, les indications de DAI gagnent du terrain dans la DAVD, qui incluent la dysfonction VD ou VG sévère ou modérée, et précisent la place de la SVP, tandis que la méxilétine renforce sa position comme traitement spécifique du syndrome du QT long de type 3.
Les principales évolutions, cardiopathie par cardiopathie, en quelques mots :
La maladie coronaire chronique :
Dans la maladie coronaire chronique, les indications du défibrillateur automatique implantable (DAI) en prévention primaire évoluent discrètement avec la stimulation ventriculaire programmée, qui peut désormais guider l’indication d’implantation chez les patients avec une FEVG entre 36 et 40 % et des TVNS documentées (IIa). La SVP reste proposée chez les patients coronariens avec syncope, comme en 2015. Un holter implantable est alors proposé chez les patients coronariens avec syncope mais SVP négative.
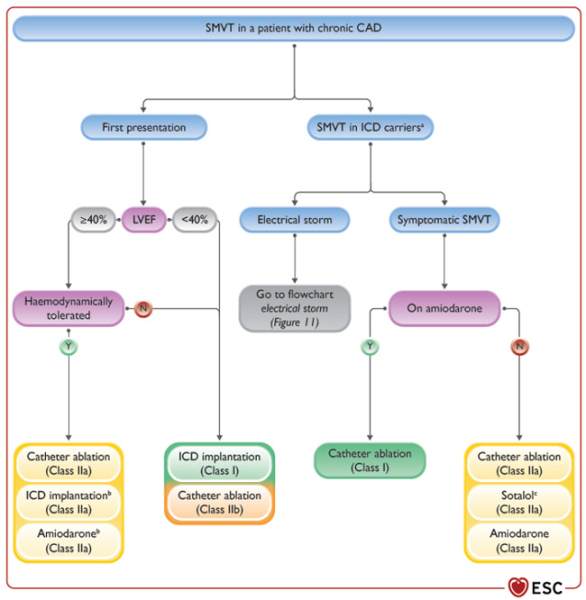
Concernant l’ablation par cathéter chez les patients avec TV monomorphe bien tolérée, si la FEVG est ≥ 40 %, elle est proposée en 1ère intention, en alternative au DAI, si les endpoints d’ablation sont bons. En cas de TV chez un patient porteur de DAI, l’ablation par cathéter doit être préférée à l’escalade thérapeutique (antiarythmiques) chez un patient déjà sous amiodarone. En l’absence de traitement antiarythmique, l’ablation par cathéter, le sotalol, et l’amiodarone sont les 3 options proposées. L’ablation par cathéter ne doit plus être proposée après un 1er épisode de TV soutenue si l’indication de DAI existe (avant ou après l’implantation) pour diminuer le risque de chocs (recommandation rétrogradée de IIa à IIb).
On peut noter aussi des nouvelles recommandations sur le vasospasme coronaire. Le DAI est désormais indiqué chez les survivants d’un arrêt cardiaque associé à un spasme coronaire. En effet, si cette cause était considérée comme une cause aiguë et curable, différentes études ont démontré des taux de récidives significatifs. Les tests de provocation du spasme coronaire doivent par ailleurs être discutés dans le bilan étiologique d’un arrêt cardiaque inexpliqué en cas de suspicion (IIb).
Les principales cardiomyopathies non ischémiques :
Dans les cardiomyopathies dilatées (CMD), les tests génétiques sont recommandés chez les patients avec des troubles de la conduction atrioventriculaire avant 50 ans, ou s’il existe une histoire familiale de cardiomyopathie ou de mort subite avant 50 ans. L’IRM est également indiquée pour le bilan étiologique et pour stratifier le risque rythmique. L’indication de DAI en prévention primaire est rétrogradée à un grade IIa (vs. I en 2015) chez les patients avec une FEVG ≤ 35 %, en revanche, chez les patients avec une dysfonction ventriculaire modérée entre 35 et 50 %, de nouveaux facteurs (≥ 2) peuvent faire poser l’indication d’implantation : fibrose à l’IRM, syncope, certaines mutations, ou une SVP positive. La SVP peut d’ailleurs désormais être proposée dans les cardiomyopathies non ischémiques chez les patients avec syncope inexpliquée pour stratifier le risque rythmique.
Dans la cardiomyopathie hypertrophique (CMH), l’évaluation du risque rythmique doit être répétée de façon périodique tous les 1 à 3 ans. Si le DAI est toujours indiqué en prévention primaire chez les patients avec un score de risque ≥ 6 % à 5 ans, dans la zone à risque intermédiaire (4-6 %), des nouveaux critères sont retenus pour éventuellement proposer une implantation prophylactique (grade IIa) : la présence de fibrose à l’IRM (≥ 15 %), une chute tensionnelle à l’effort, la présence d’une mutation sarcomérique, une FEVG < 50 %, ou un anévrisme apical. Ces guidelines introduisent également le HCM risk-kids score qui peut être utilisé chez les enfants avant 16 ans (IIa).
Dans la dysplasie arythmogène ventriculaire droite (DVDA), le DAI était principalement proposé en prévention secondaire dans les recommandations de 2015. Les indications du DAI en prévention primaire sont mieux précisées avec une indication chez les patients avec une dysfonction sévère du VD ou du VG (IIa), une syncope a priori rythmique (IIa), ou une dysfonction ventriculaire modérée associée à des TVNS ou une SVP positive (IIa).
Les canalopathies :
Dans le syndrome du QT long, les bétabloquants non cardio-sélectifs (nadolol ou propranolol) doivent être privilégiés. La mexilétine doit être proposée dans les syndromes du QT long de type 3 avec un QT allongé. Il est aussi suggéré d’utiliser le calculateur de risque (en fonction du QTc et de la mutation), bien que le résultat de ce score ne soit pas encore utilisé pour guider une indication d’implantation en prévention primaire.
Dans les TV catécholergiques, les bétabloquants non cardio-sélectifs doivent aussi être utilisés. Bien que le niveau d’évidence reste très faible, la flécaïne semble être efficace en cas de persistance d’arythmies ventriculaires sous bétabloquants.
Dans le syndrome de Brugada, chez les patients avec un type 1 induit, le diagnostic de syndrome de Brugada doit être posé uniquement chez les patients avec syncope inexpliquée ou avec une histoire familiale de Brugada ou de mort subite inexpliquée avant 45 ans. Le holter implantable peut être proposé chez les patients avec syncope inexpliquée (IIa). L’ablation par cathéter est désormais une recommandation de grade IIa chez les patients avec des arythmies ventriculaires récidivantes (vs. IIb en 2015).
Les recommandations en détails
1) Épidémiologie de la mort subite, sensibilisation du public et stratification du risque
Les morts subites cardiaques représentent environ 50 % de la mortalité cardiovasculaire. Cette incidence croit drastiquement avec l'âge, et la part des hommes est prédominante à tout âge. Les étiologies dépendant de l'âge : chez les plus jeunes, elles sont dominées par les maladies génétiques et les cardiomyopathies, alors que la coronaropathie devient prédominante.
Le taux de survie après un ACR extrahospitalier demeure faible malgré des disparités régionales importantes. Les campagnes de formation aux premiers secours (idéalement répétées et dès l'enfance) ont montré une diminution du temps de no-flow et une amélioration du pronostic.
L’accès public aux DAE est recommandé dans les lieux où des ACR sont le plus susceptibles de se produire (Grade IB). Une réanimation cardiopulmonaire doit être réalisée rapidement par les témoins en cas d’ACR extrahospitalier (Grade IB). La promotion de la formation aux premiers secours aux populations est recommandée pour améliorer les taux de RCP et l’utilisation du DAE (Grade IB). Les méthodes d’alertes téléphoniques des témoins ayant reçu une formation aux premiers secours à proximité d’un ACR extrahospitalier doivent être considérées (Grade IIaB).
2) Outils d’évaluation des arythmies ventriculaires :
Quels examens complémentaires ?
En plus de la clinique, l'ECG et l'ETT sont deux examens majeurs pour l'évaluation initiale des patients présentant des arythmies ventriculaires pour dépister une cardiopathie structurelle sous-jacente.
Le test d'effort possède également un rôle diagnostic et pronostic important, mais c'est l'IRM qui est l'examen le plus rentable et précis dans ce contexte. Le scanner apporte également des informations précieuses du fait de sa haute résolution spatiale.
Les explorations électrophysiologiques endocavitaires, notamment la stimulation ventriculaire programmée, permettent une exploration invasive qui guide les indications de DAI.
Les tests diagnostiques de provocation font l'objet d'une nouvelle sous-partie dans ces recommandations. À noter que les tests à l'épinéphrine ne sont plus recommandés pour le diagnostic de syndrome du QT long en raison de nombreux faux positifs.
Les recherches génétiques ont considérablement progressé (plus performantes grâce aux séquences nouvelles générations, plus disponibles et moins chères). Ces tests utilisent désormais de larges panels de gènes prédéfinis. La réalisation du test génétique ainsi que le conseil génétique délivré sur les éventuelles conséquences doivent être réalisés par une équipe d'experts multidisciplinaire (Grade IC). Les tests génétiques sont recommandés devant toute suspicion d’arythmie ventriculaire ou de mort subite d’origine génétique (Grade IB). La réalisation de tests génétiques n’est pas recommandée chez les patients index si les preuves d'une maladie génétique sont insuffisantes (Classe IIIC).
Recommandations pratiques : quelles stratégies d’exploration à partir de 5 cas tirés de la vie réelle ?
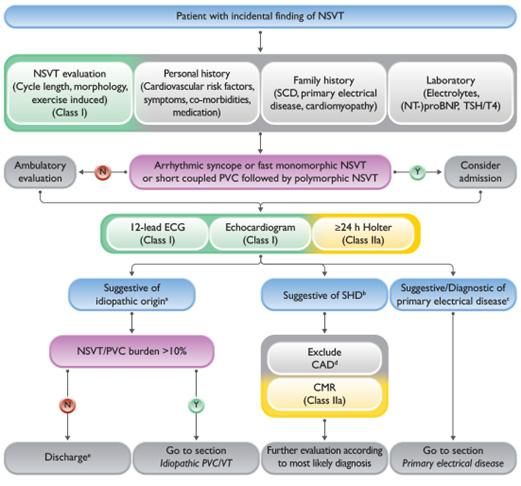
Scénario 1 : Découverte fortuite d'une TVNS
- La survenue d’une arythmie ventriculaire (ESV, TVNS, TVS) nécessite au minimum la réalisation d’un ECG 12 dérivations et d’une ETT (I/C), et la réalisation d’un Holter ECG d’au moins 24h doit être considérée (IIa/C)
- Ce bilan permet de rechercher une cardiopathie structurelle, et, en cas d’exclusion d’une coronaropathie, il pourra être complété d’une IRM (IIa/B).
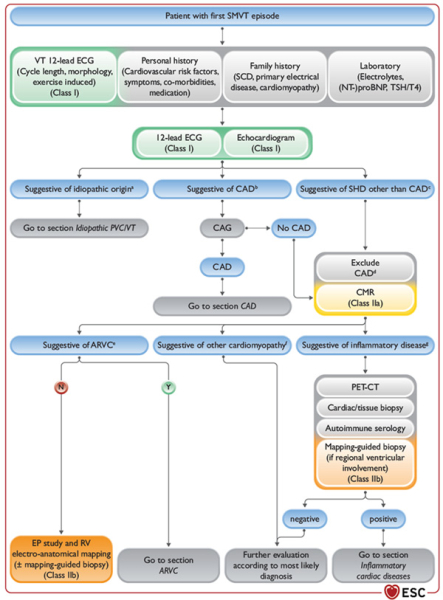
Scénario 2 : Premier épisode de TV soutenu monomorphe
La TV soutenue monomorphe est la plupart du temps associée une cardiopathie structurelle sous-jacente. La recherche d’une coronaropathie, voire d’une IRM, en cas d’exclusion d’un tel processus reste la règle.
En cas de TV soutenue monomorphe, il pourra être discutée la réalisation d’une étude électrophysiologique avec un mapping électro-anatomique, voire des biopsies guidées par le mapping selon la suspicion étiologique (IIb/C).
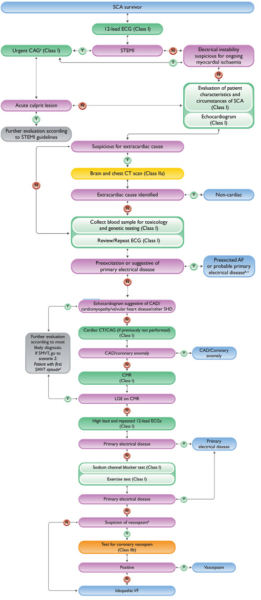
Scénario 3 : Mort subite cardiaque ressuscitée
Le prise en charge de la mort subite se fait en plusieurs étapes :
- Un ECG 12 dérivations et une ETT « compréhensive » doivent être réalisés (I/A)
- Il n’y a pas d’indication à une coronarographie en urgence en l’absence de sus-ST. En cas d’instabilité électrique, une coronarographie doit être réalisée (I/C)
- En l’absence de cause extracardiaque évidente, l’analyse par une équipe multidisciplinaire est recommandée (I/B) et si les caractéristiques cliniques, électrocardiographiques et échographiques n’orientent pas vers une cause cardiaque, la réalisation d’un scanner thoracique et cérébral doit être considérée (IIa/C).
- En l'absence d'arguments pour une cause extracardiaque, il faut répéter les ECG et réaliser un reviewing des ECG antérieurs avec réalisation d’ECG en position haute ainsi que des prélèvements sanguins avec toxicologie sanguine, ainsi que des tests génétiques (I/B) qui devront être conservés
- En cas de négativité de tous ces examens, il faut éliminer une coronaropathie si celle-ci n'avait pas encore été réalisée par coroscanner ou coronarographie (I/B), puis réaliser une IRM cardiaque (I/B).
- Si ces examens sont négatifs, il faudra envisager et un test de provocation par blocage des canaux sodiques (type Ajmaline) et un test d’effort (I/B).
- Enfin, et si ces examens reviennent négatifs, la recherche d'un vasospasme pourra être envisagée, avec un niveau de recommandation plus faible que les précédents (IIb/B) grâce à des tests de provocation adaptés.
- Si l'ensemble de ces examens est négatif, le diagnostic de FV idiopathique pourra être retenu.
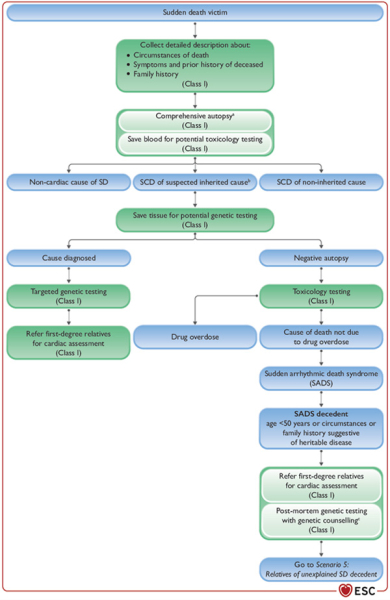
Scénario 4 : Mort subite (non ressuscitée)
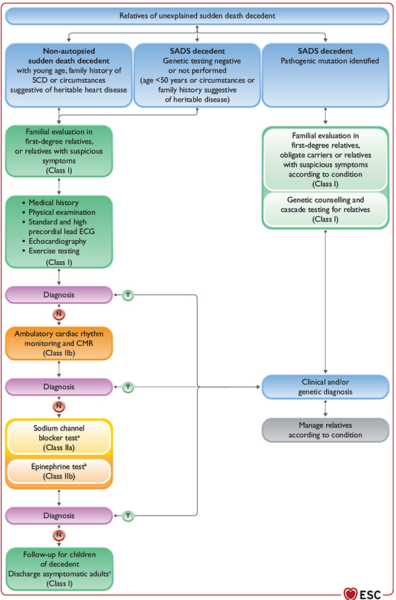
- Après une mort subite, il est important de collecter précisément les circonstances de la mort, ainsi que les antécédents personnels et familiaux (I/B).
- Une autopsie est recommandée ainsi que des prélèvements sanguins avec réalisation d’analyses toxicologiques pour toute mort subite « inattendue » et en particulier avant 50 ans (I/B).
Au décours de ces examens, soit on retient le diagnostic de MS non cardiaque, soit de MS cardiaque mais sans suspicion d’héritabilité, soit de MS cardiaque avec suspicion d’héritabilité.
C’est dans cette dernière situation que les explorations sont poursuivies :
- En cas de suspicion de mort subite d’origine cardiaque, il est recommandé de conserver des échantillons avec possibilité d’extraction d’ADN par la suite, et de consulter un anatomo-pathologiste en cas de suspicion de cause héritable ou de mort subite inexpliquée (I/B).
- Des tests génétiques sont également recommandés en cas de suspicion d’héritabilité ou de mort subite sans cause évoquée. Une analyse génétique post-mortem à la recherche de maladies électriques primaires est recommandée chez les patients < 50 ans ou en cas de points d’appels (I/B).
- Si les tests génétiques reviennent positifs, il est recommandé que les apparentés du premier degré bénéficient d’une évaluation cardiologique (I/B).
Scénario 5 : Apparentés d'une victime de mort subite inexpliquée
- Une enquête familiale des apparentés d’une victime de mort subite inexpliquée est recommandée dans les situations suivantes (I/B) :
- Apparentés au 1er degré
- Proches possiblement atteints de la mutation au vu de l’enquête familiale
- Proches avec symptômes suspects
- En cas de suspicion d’héritabilité
- Cette enquête familiale doit être complétée si possible par un test génétique post-mortem afin de détecter une éventuelle mutation pathogénique. (I/B).
3) Traitement des arythmies ventriculaires
Aspects généraux : prise en charge de la TV et de l’orage rythmique
- En 1er lieu, il convient de rechercher une cause réversible (désordres hydro-électriques, spasme, ischémie, hypoxémie, fièvre, jeûne…) (I/B) et/ou iatrogène (allongeur du QT, diurétique susceptible d’altérer l’équilibre hydro-électrique…). Il est recommandé d’arrêter le médicament imputé (I/B). Malgré la découverte d’une cause réversible, l’implantation d’un DAI peut être envisagée, sur la base d’une évaluation individuelle du risque (IIa/C).
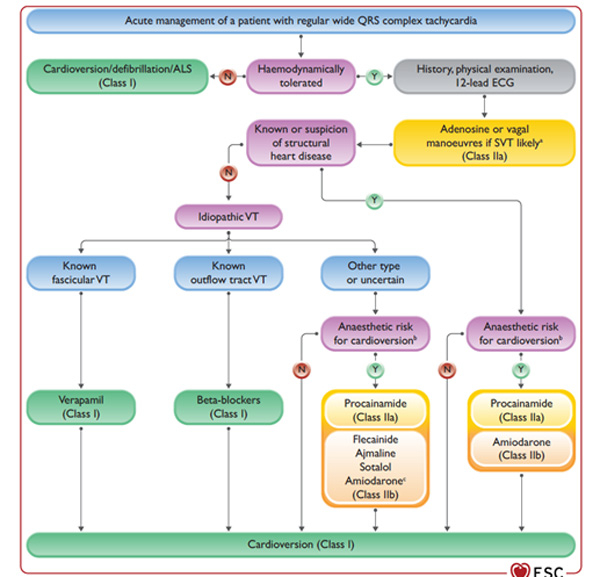
- En cas de TVS avec instabilité hémodynamique, une cardioversion électrique est recommandée en 1ère intention (I/B), si possible synchronisée.
Hors situation d’instabilité hémodynamique :
- En cas de doute diagnostic, en particulier avec une TSV, les manœuvres vagales ou l’administration d’adénosine peuvent être envisagées (IIa/C). Certaines TV peuvent être arrêtées par l’adénosine, et celle-ci doit être évitée en cas de suspicion de FA avec pré-excitation (de même que les bétabloquants et l’amiodarone).
- Devant une TV sur cardiopathie structurelle sous-jacente, le risque anesthésique doit être pris en compte. En cas de risque faible, la réduction par cardioversion électrique est recommandée (I/C), alors qu’en l’absence de risque particulier, on utilisera des antiarythmiques, le procaïnamide (IIa/B), voire, avec un grade de recommandation plus bas, l’amiodarone (IIb/B).
- Devant une TV idiopathique sans cardiopathie structurelle le Vérapamil est recommandé en 1ère intention sur TV fasciculaire (I/C), les bétabloquants IV sur TV infundibulaire (I/C). Dans les autres cas, c’est la cardioversion électrique qui sera recommandée (I/C) si le risque anesthésique est bas, et des anti-arythmiques dans le cas inverse, avec un niveau de recommandation IIa/B pour le procaïnamide, IIb/B pour l’amiodarone et IIb/C pour le sotalol, la flécaïne et l’Ajmaline.
- Le Vérapamil ne doit pas être utilisé en cas de doute diagnostic (III/B)
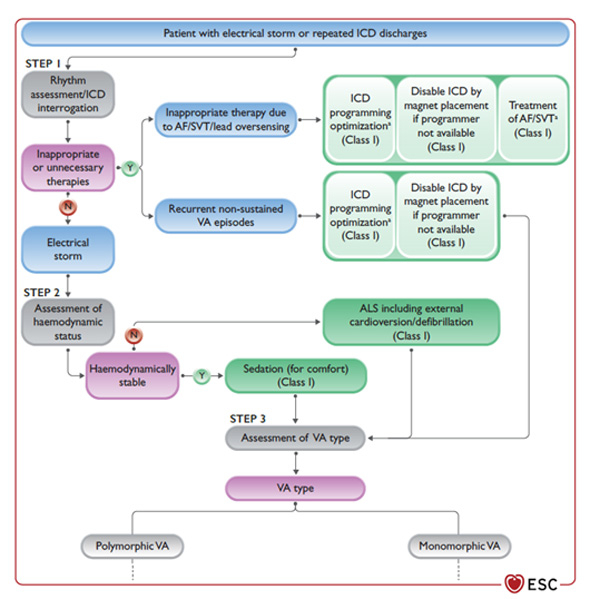
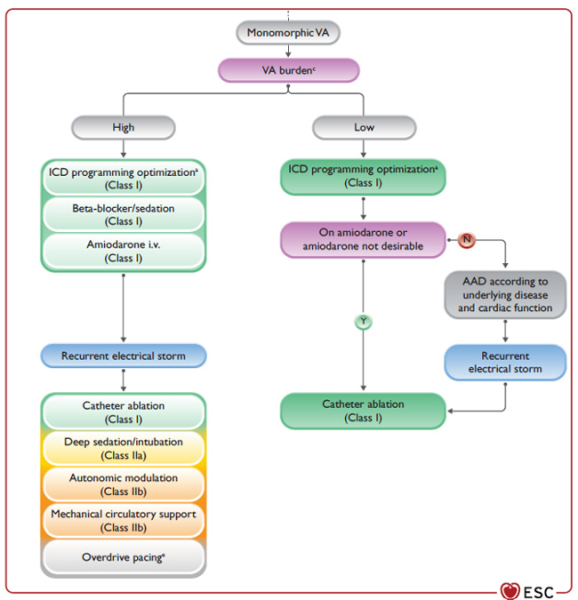
En cas d’orage rythmique,
- Il faut écarter au préalable des chocs inappropriés etn le cas échantn optimiser la programmation du DAI ou arrêter les thérapies (I) et traiter une éventuelle TSV déclenchante.
- Si le patient est stablen il y a une indication à une sédation légère à modérée (I/C) permettant le confort du patient et la réduction du tonus sympathique.
- En cas d’orage rythmique réfractaire à un traitement médical, il faudra envisager une sédation profonde avec intubation (IIa/C) et l’assistance circulatoire (IIb/C).
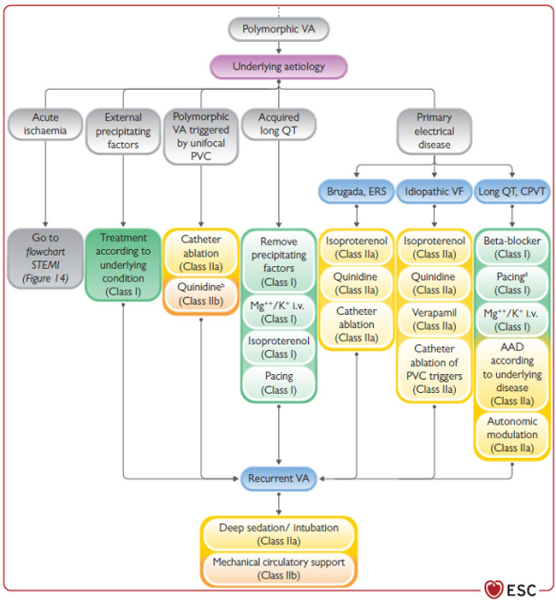
- Selon l’étiologie, le traitement médical pourra comprendre :
- ESV unifocale : Ablation (IIa/C) voire la quinidine (IIb/C)
- QT long acquis : K+ / Mg2+ (I/B), isoprénaline voire SEES
- QT long congénital : K+ / Mg2+, BB, SEES et modulation autonomique
- Brugada / FV idiopathique : isoprénaline, quinidine et ablation (IIa)
Figure : Algorithme de prise en charge des tachycardies à QRS larges
Figure : Algorithme de prise en charge de l’orage rythmique
Figure (suite) : Algorithme de prise en charge de l’orage rythmique
Recommandations sur les DAI
- L’implantation d’un DAI ne doit pas être proposé en cas de TV récurrente non contrôlée (III/C). Un prérequis à l’implantation est une survie estimée à plus de 1 an avec une bonne qualité de vie (I/C). Elle est recommandée sur FV documentée ou TV avec retentissement hémodynamique, en l’absence de cause réversible (I/A). Si le DAI n’est pas disponible / contre-indiqué ou refusé par le patient, une alternative médicamenteuse par l’amiodarone peut être envisagée (IIb/C) : l’autre alternative étant l’ablation d’ESV, à la condition d’avoir démasqué une ESV déclenchante (IIb/C). L’ETT fait partie du bilan pré-implantation d’un DAI pour rechercher une indication à l’implantation d’un CRT-D (I/C). Le DAI sous-cutané est une alternative au DAI trans-veineux si le patient ne nécessite pas de stimulation anti-bradycardique, d’ATP ni de resynchronisation (IIa/B).
- L’optimisation de la programmation du DAI est recommandée (I/A), comprenant la réduction des stimulations ventriculaires inutiles en l’absence d’indication (I/A), la programmation de la zone la plus basse de thérapie > 188 BPM en prévention primaire, d’au moins une zone d’ATP en cas de cardiopathie ischémique (I/A). Il convient également de programmer en première ligne du burst (rafale) plutôt que des rampes, d’activer les alertes de dysfonction de sonde, d’activer la télésurveillance (I/B). Pour les DAI sous-cutanés, il est recommandé de programmer 2 zones de détection en activant l’algorithme de discrimination dans la zone inférieure (I/B). Il y a une indication formelle à une procédure ablative en cas de chocs inappropriés sur TVS ou sur FA malgré une programmation optimale (I/C). Les recommandations insistent sur l’évaluation de l’impact psychologique et la prise en charge psychologique des patients implantés de DAI (I/C) en particulier en cas de chocs et sur la nécessité de discuter collégialement et avec la famille la désactivation des thérapies en cas de détérioration du statut de santé(I/C).
- Afin de prévenir les complications de matériel, il est recommandé de privilégier le DAI simple chambre au double-chambres en l’absence d’indication à une stimulation atriale ou atrio-ventriculaire (I/A) et les sondes single-coils aux sondes double-coils (IIa/C).
- Le port d’un gilet portable de défibrillation peut être considéré lorsqu’il existe une indication à un DAI en prévention secondaire avec impossibilité temporaire (IIa/C) ou à la phase aiguë d’un IDM chez des patients sélectionnés (IIb/B)
4) Situations particulières
Maladie coronaire
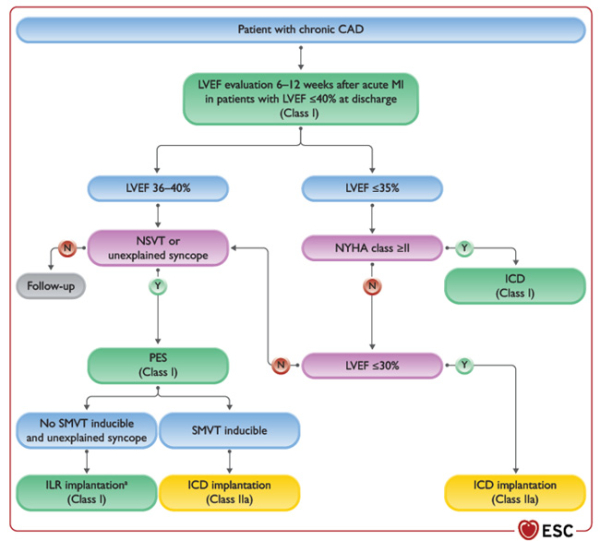
- À la phase aiguë d'un SCA, les bétabloquants IV sont possibles (IIa/A) avant même la revascularisation en cas d'arythmie ventriculaire, même si le traitement le plus efficace reste la revascularisation (I/A). En cas de TV/FV après revascularisation, l'adjonction, d’amiodarone IV en plus des BB doit être considérée (II/C) puis de lidocaïne (IIb/C). S’il persiste ou survient des épisodes de FV/TV mal tolérée > 48h après la revascularisation, il y a une indication à l’implantation d’un DAI (I/A).
- En cas de syncope inexpliquée malgré explorations non invasives après un STEMI, il faut réaliser une stimulation ventriculaire programmée (I/A) qui posera l'indication à l'implantation d'un DAI (IIa/B) en cas de positivité.
- Chez les patients coronariens, il y a une indication formelle à l’implantation d’un DAI en cas FEVG ≤ 35 % avec une dyspnée NYHA ≥ II malgré > 3 mois de traitement médical optimal (I/A) et celle-ci peut se discuter en cas de NYHA I, avec un seuil de FEVG < 30 % malgré > 3 mois de traitement optimal (IIa//B), ou chez les patients avec un FEVG < 40 %, des épisodes de TVNS motivant la réalisation d’un SVP qui reviendrait positive (IIa/B). Si celle-ci revient négative, alors il y a une indication à l’implantation d’un holter implantable longue durée.
- En cas de TV symptomatique, d’orage rythmique ou de chocs sur TV chez les patients coronariens ; l’adjonction d’amiodarone doit être considérée et/ou le remplacement du bétabloquant par le sotalol (IIa/B) mais en cas de persistance sous amiodarone, il faut privilégier une procédure ablative à une escalade des thérapeutiques antiarythmiques (I/B). Cependant, en cas de TV avec bonne tolérance hémodynamique et de FEVG > 40 % ; une procédure ablative peut permettre de surseoir à l’implantation (IIa/C) et le DAI sera alors plutôt en 2ème intention en cas d’échec de l’ablation ou de non-disponibilité (IIa/C).
- Aucun antiarythmique (sauf BB) ne doit être utilisé en prévention des arythmies (III/B) en cas syndrome coronarien aigu ou chronique
- L'implantation d'un DAI doit être considérée (IIa/C) après une mort subite récupérée secondaire à un spasme coronaire.
Figures : Arythmies ventriculaires chez le patient coronarien
ESV idiopathiques et cardiomyopathie induite aux ESV
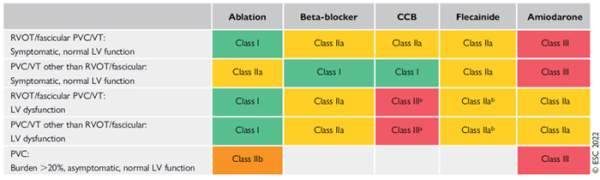
- En cas d'ESV idiopathiques symptomatiques, il faudra réserver l'ablation en 1ère intention (I/B) et le traitement médical (bétabloquants, flécaïne ou inhibiteurs calciques non-dihydropyridines) en 2ème intention (IIa/B) pour les ESV fasciculaires et infundibulaires VD ; et pour les autres origines, plutôt le traitement médical (bétabloquant / inhibiteurs calciques) en 1ère intention (I/C) et l'ablation ou le recours à la flécaïne en 2ème intention (IIa/B).
- En cas d’ESV idiopathiques asymptomatiques, des ETT régulières sont nécessaires en cas de FEVG préservé à partir d’une charge en ESV > 10 % (I/C) et une l’ablation est possible si la charge > 20 % (IIb/B)
- L’amiodarone n’est pas un traitement de 1ère ligne des ESV idiopathiques (III/C)
- Le diagnostic de cardiopathie ESV- induite peut être suspecté en cas de FEVG abaissée à partir d'une charge en ESV > 10 % (IIa/C).
- Il y a une indication formelle à une ablation en cas de cardiopathie ESV-induite (I/C), et les antiarythmiques doivent être considérés en cas d'échec ou haut risque (IIa/C).
- Chez les patients implantés d’une CRT et non-répondeurs, dont les ESV limitent les possibilités d'une stimulation biventriculaire optimale, l'ablation ou un traitement antiarythmique doivent être considérés (IIa/C).
- En cas de présentation atypique (IIa/C) ou de cardiomyopathie induite par les ESV (IIa/B), l'IRM doit être considérée.
Figure : Traitement des ESV idiopathiques.
Cardiomyopathies dilatées (CMD) et non dilatées hypokinétiques (CMNDH)
- Le bilan comprend un test génétique incluant au moins la recherche des gènes LMNA, PLN, RBM20 et FLNC en cas de troubles conductifs < 50 ans, d'antécédents familiaux de CMD / CMNDH ou d'antécédents familiaux au premier degré de mort subite < 50 ans (I, B) et doivent être considérés chez les patients présentant une CMD / CMNDH sporadique à un âge jeune ou en cas de suspicion de pathologie héréditaire (IIa/C). Une IRM avec rehaussement tardif doit être considérée (IIa/B) et une EEP en cas de syncope inexpliquée (IIa/C).
- Les indications de DAI dans la CMD /CMNDH sont :
- FEVG < 35 % NYHA > 2 après > 3 mois de traitement optimal (IIa/A)
- Mutation du gène LMNA avec un risque de MS à 5 ans > 10 % et TVNS ou troubles conductifs AV ou FEVG < 50 % (IIa/C)
- FEVG < 50 % et au moins 2 FDR parmi syncope, rehaussement tardif à l'IRV, SVP positive, mutation LMNA, PLN FLNC ou RBM20 (IIa/C)
- Mort subite récupérée sur TV /FV ou TV avec instabilité hémodynamique (I/A)
- Chez les apparentés du 1er degré, un dépistage par ECG et ETT est recommandé si le patient index est diagnostiqué avant 50 ans, en cas d'arguments en faveur d'une cause héritable ou d’antécédents familiaux de CMD /CMNDH ou de mort subite (I/C) mais reste envisageable pour les apparentés sporadiques (IIb/C).
- L’activité physique de haute intensité incluant le sport en compétition n’est pas recommandée en cas de CMD / CMNDH ou d’une mutation LMNA (III).
- En cas de CMD par non-compaction du VG, les indications à l’implantation d’un DAI sont superposables à celles des CMD (IIa/C)
CMH
- Le bilan comprend une IRM et la réalisation de tests génétiques (I/B).
- Une évaluation du risque de mort subite est préconisée tous les 1-3 ans en cas de stabilité clinique (I/C).
- L’implantation d’un DAI est recommandée en cas de TV mal tolérée /FV (I/A) et doit être considérée si le risque de MS à 5 ans > 6% (IIa/B) ou entre 4 et 6 % avec un FDR supplémentaire parmi rehaussement tardif significatif en IRM (> 15 % de la masse VG), FEVG < 50 % , anomalies tensionnelles, anévrisme apical ou mutation pathologique « sarcomérique » (IIa/B) ou sans (IIb/B). Chez les patients à bas risque (SCM risk < 4 %), l’implantation d’un DAI est également possible en cas de rehaussement tardif significatif, anévrysme apical VG, FEVG < 50 % (IIb/B).
- Pour les enfants de moins de 16 ans, l’implantation d’un DAI est à considérer si le score HCM Risk-Kids > 6% (IIa/B).
- L’activité physique de haute intensité peut être envisagée pour les patients adultes asymptomatiques atteints de CMH sans marqueurs de risque (IIb/C).
- Un dépistage des apparentés de 1er degré est recommandé incluant ECG et ETT (I/C).
DAVD
- En cas de suspicion de DAVD, il convient de réaliser une IRM, une consultation génétique (I/B), et une SVP peut s’envisager en cas de symptômes suspects d’arythmies ventriculaires (IIB/C).
- Il est possible d'utiliser des bétabloquants en cas de DAVD confirmée, de manière préventive (IIb/C), en particulier en cas de de TV, soutenue ou non (I/A).
- Les indications de DAI dans la DAVD sont la notion de syncope sur arythmie (IIa/B), dysfonction VG ou VD sévère ou modérée, si symptomatique, avec des épisodes de TVNS (IIa/C), en cas de SVP positive (IIa/C) et en prévention secondaire (I/A). Si l’indication à un DAI est retenue pour DAVD, l’implantation d’un device apte à réaliser de l’ATP doit être considérée (IIa/B).
- En cas de persistance de TV soutenue ou de chocs sur DAI malgré BB, une procédure ablative doit être envisagée (IIa/C).
- L’activité physique de haute intensité doit être évitée en cas de DAVD confirmée (III/B) et peut être considérée chez les porteurs de certaines mutations, même en l’absence de phénotype (IIb/C).
- Un dépistage par ECG et ETT est recommandé chez les apparentés du 1er degré (I/A).
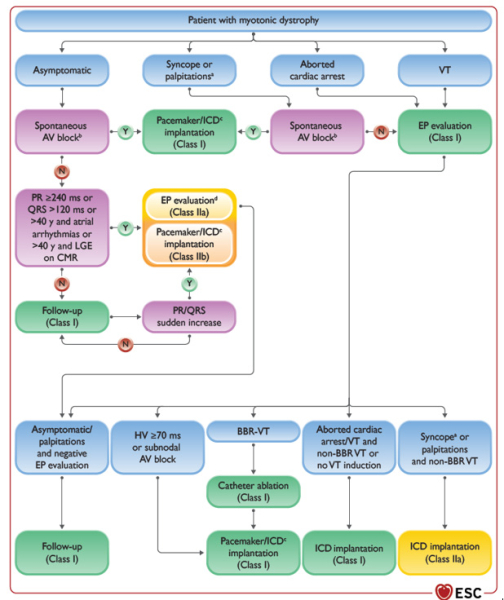
Maladies neuromusculaires
- Un ECG 12D annuel est recommandé chez les patients atteints de dystrophies musculaires (I/C) et pas d’indication systématique à une EEP ou SVP en l’absence de suspicion d’arythmie ou de symptômes suspects (III/C).
- Le traitement de la dysfonction ventriculaire et des arythmies ventriculaires sont comparables à la population générale (I/C).
- En cas de symptômes suspects, d'élévation brutale du PR ou des QRS, de PR > 240 msec ou de QRS > 120 msec, il y a une indication à une EEP(IIa/B).
- Un DAI est recommandé en cas de TV soutenue (non-branche à branche) ou d’ACR récupéré. En cas de TV de branche à branche, c’est l’ablation qui est préconisée (I/C). Dans ce cas, il y a une indication à une ablation de PM/DAI (I/C).
- En cas d’indication à un PM sur un patient avec dystrophie musculaire des ceintures de type 1B ou un Emery-Dreifuss, l’implantation d'un DAI est à considérer (IIa/C). Les patients présentant une dystrophie de Duchenne /Becker présentant un rehaussement tardif significatif à l'IRM peuvent être éligibles à l'implantation d'un DA (IIb/C).
Figure : Algorithme de prise en charge de la dystrophie myotonique
Maladies inflammatoires
- En phase aiguë d’une myocardite, il est possible de proposer des antiarythmiques en cas de TV soutenue ou non (IIa/C) et l’implantation d’un DAI doit s’envisager avant la sortie en cas de FV/TV mal tolérée (IIa/C).
- Sur myocardite chronique, l'implantation d'un DAI est recommandée en cas de mauvaise tolérance hémodynamique (I/C) mais reste possible même si la tolérance hémodynamique est bonne (IIa/C). En cas de bonne tolérance hémodynamique, de FEVG préserve et de cicatrice restreinte, une procédure ablative peut être une alternative (IIb/C).
- En post-myocardite, un traitement antiarythmique peut être (IIa/C) sur TV symptomatique récurrente voire une ablation en centre spécialisé en 2ème intention en cas d'inefficacité ou mauvaise tolérance de ceux-ci (IIa/C).
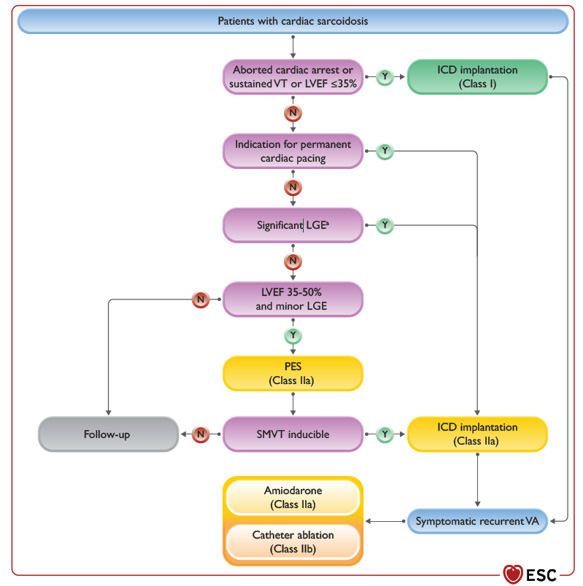
- Dans la sarcoïdose cardiaque, il y a une indication à un DAI en cas de TV soutenue ou de FEVG < 35 % (I/B), en cas de rehaussement tardif significatif à l’IRM au décours de la phase aiguë inflammatoire (IIa/B). Si la FEVG est entre 35 et 50 % et que l’IRM retrouve un rehaussement tardif mineur, peut se discuter (IIa/C) la réalisation d’une stimulation ventriculaire programmée pour guider l’indication à l’implantation d’un DAI en cas de positivité (IIa/C). Enfin, S’il existe une indication à un PM, alors il faut envisager plutôt l’implantation d’un DAI indépendamment de la FEVG(IIa/B).
- Dans la sarcoïdose cardiaque, en cas d’arythmies ventriculaires récurrentes et symptomatiques, le traitement comprend l’amiodarone (IIa) voire en cas d’inefficacité / mauvaise tolérance une procédure ablative (IIb) en 2ème intention
- Dans la cardiomyopathie de Chagas, l’amiodarone peut être utile pour réduire la charge en arythmie ventriculaire (TV /ESV) et l’ablation par cathéter en 2ème intention (IIa/C). L’implantation d’un DAI reste possible en cas TV symptomatique malgré amiodarone / bétabloquant) ablation (IIb/C).
Figure : Algorithme de prise en charge rythmologique de la sarcoïdose
Syndrome du QT long
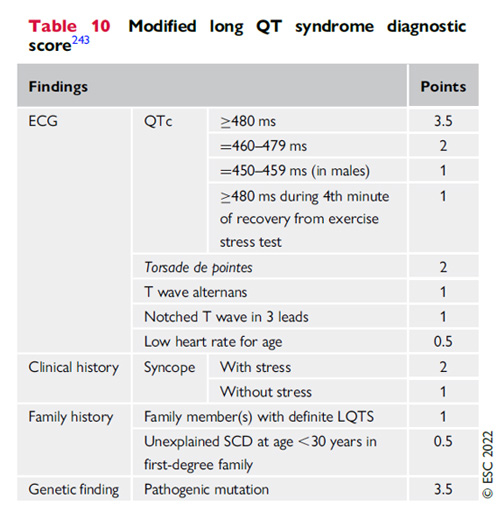
- Le diagnostic de syndrome du QT long repose sur QTc > 480 msec ou un score LQTS > 3 (I/C), et peut être considéré en cas de syncope avec un QT compris entre 460 et 480 msec sans cause secondaire (IIa/C). Un test génétique est recommandé systématiquement (I/C). En cas de mutation retrouvée, le diagnostic est posé même indépendamment du QT (I/C).
- Il n'y a pas d'indication à un test d'épinéphrine pour le diagnostic en routine (III/C).
- En cas de diagnostic confirmé, l'éviction des médicaments allongeant le QT est recommandée ainsi qu'un bon contrôle hydroélectrolytique (I/C).
- Les bétabloquants idéalement non sélectifs, comme le nadolol ou le propranolol, sont recommandés (I/B) et la méxilétine de manière plus spécifique aux syndromes du QT long de type 3 (I/C).
- Les bétabloquants peuvent aussi être utilisés, même devant un QT normal en présence d'une mutation propre à un syndrome du QT long (IIa/B).
- L'implantation d'un DAI est recommandée pour les patients symptomatiques sous BB et traitements spécifiques (I/C), et peut être considérée pour les patients asymptomatiques présentant un haut risque (selon les calculateurs de risque LQTS 1-2-3) (IIb/B).
- En cas de contre-indication au DAI ou de chocs multiples ou de syncope, une dénervation sympathique est recommandée (I/C).
Tableau : Score de QT long
Syndrome de Brugada
- Le diagnostic de syndrome de Brugada est posé en cas de pattern de Brugada de type 1 sans autre atteinte cardiaque (I/B), en cas de test de positif à l’Ajmaline ou tout autre bloqueur des canaux sodiques ; en cas d’ACR /FV au cours d’une fièvre. Il doit être envisagé en cas de pattern de Brugada de type 1 induit en présence d’au moins l’une des conditions suivantes (IIa/C), syncope a priori rythmique ou respiration nocturne agonique, antécédent familial de syndrome de Brugada, antécédent familial de mort subite < 45 ans sans anomalies autopsiques et une suspicion de syndrome de Brugada. Il n’y a pas d’indication à un test à l’Ajmaline en cas de pattern de type 1 (III/C).
- Un test génétique recherchant le gène SCN5A est recommandé (I/C).
- Il recommandé l’éviction de certains médicaments, drogues, la consommation excessive d’alcool et de traiter médicalement les fièvres.
- En cas de syncope, l'implantation d'un DAI est recommandée si une cause rythmique est retrouvée (IIa/C) ; sinon, d'un Holter longue durée.
- L'indication d'un DAI est recommandée en cas d'ACR ou de TV soutenue (I/C), à considérer en cas syncope secondaire à une arythmie ventriculaire chez un patient avec un pattern de type 1 (IIa/C) et de positivité à la SVP qui sera possible en cas de Brugada type 1 spontanée (IIb/B). Lorsqu’il y a une contre-indication à l'implantation, un traitement par Quinidine est à considérer (IIa/C). L’ablation est par contre recommandée chez les patients avec des arythmies ventriculaires récidivantes / chocs appropriés par le DAI malgré le traitement pharmacologique (IIa/C).
Syndrome de repolarisation précoce (SRP)
- Le pattern de repolarisation précoce (RP) est diagnostiqué par une élévation du point J > 1 mm sur au moins 2 dérivations adjacentes dans les territoires latéraux et/ou inférieurs. Le diagnostic syndrome de repolarisation précoce est posé lorsqu’un patient présente une FV ou TV polymorphe ressuscitée et la présence de ce PRP (I/C) et doit être considérée après une mort subite avec autopsie négative et des ECG antémortem retrouvant ce pattern de RP.
- Un dépistage des apparentés au premier degré avec un ECG à la recherche d’un pattern de RP à haut risque est à considérer chez les patients avec SRP (IIa/B). Il n’y a pas d’indication à une évaluation clinique de routine en cas de pattern de RP (III/B). En cas de diagnostic, des tests génétiques sont possibles (IIb/C).
- En cas de syncope avec facteurs de risque (ECG à haut risque ou antécédant familial de MS ou de SRP), peut se discuter l’holter implantable longue durée (IIa/C) ou le DAI d’emblée (IIb/C) ou la Quinidine ; alors que, s’il n’y a pas de FDR, il y a une indication à un holter implantable longue durée (IIa/C) sans discussion avec un DAI. La simple présence de FDR (ECG à haut risque ou antécédant familial de MS inexpliquée) peut poser l’indication à un Holter longue durée (IIa) voire à un DAI (IIb/C). Il n’y a pas d’indication à un DAI en cas de pattern isolé chez un patient asymptomatique sans FDR particulier.
- L’isoprénaline est recommandée sur orage rythmique secondaire à un syndrome de Brugada mais aussi SRP (IIa/C). La quinidine est également une possibilité en cas de SRP (IIa/C). En cas de chocs récurrents sur DAI, la quinidine sera à envisager. En cas d’échec, l’ablation d’une éventuelle ESV déclenchante est à considérer (IIa).
Pour en savoir plus, consultez les guidelines complètes, en langue anglaise, présentées lors de l'ESC 2022 ("2022 ESC Guidelines for the management of patients with ventricular arrhythmias and prevention of sudden cardiac death") :
Toute l'actualité de l'ESC 2022
Ce compte rendu de l'ESC 2022 vous est proposé avec le soutien institutionnel de :
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio Online ou de la SFC, et n'engage pas leur responsabilité.
|