7 minutes de lecture
Focus sur le coroscanner, un couteau suisse sous-employé
Publié le jeudi 13 septembre 2018
Cette revue vous est présentée par le Dr Adrien Pasteur-Rousseau, cardiologue à l’Institut Cœur Paris Centre à Paris et membre du CCF.
Introduction
Le coroscanner est habituellement prescrit dans une seule indication : écarter une cause coronaire chez un patient à faible risque cardiovasculaire présentant une douleur thoracique atypique. On l’exploite donc uniquement pour sa valeur prédictive négative, à l’image d’un couteau suisse que l’on n’utilise que pour décapsuler des bouteilles.
En effet, si le couteau suisse a de multiples fonctionnalités qui peuvent s’adapter à différentes nécessités, le scanner a lui aussi une multitude d’utilisations possibles selon la question posée. Il est donc dommage de ne pas les prendre en compte. Alors évidemment, comme le couteau suisse qui est lourd en poche et qui coûte cher à l’achat, le scanner a des inconvénients. Il nécessite une perfusion de produit de contraste et est irradiant. Cela dit, l’irradiation est faible et diminue d’année en année avec les progrès de la technique (1), si bien que et prendre un vol transatlantique vous coûtera davantage en termes d’irradiation que de réaliser un coroscanner bien fait. Faut-il pour autant arrêter de visiter nos amis québécois ?
Par ailleurs, le prix de l’examen, fixé par la Sécurité Sociale, est bas et la disponibilité du scanner est assez grande sur le territoire français contrairement à l’IRM.
Les apports du coroscanner
Maintenant que nous avons évoqué ses principaux inconvénients, quels sont donc les apports potentiels de cet outil ?
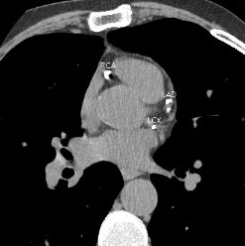
- Une sensibilité élevée pour la détection des plaques coronaires ;
- Une visualisation de(s)
- des plaques calcifiées « stables » et des plaques hypodenses peu calcifiées « instables » et à risque de rupture (donc d’infarctus du myocarde (IDM)), ceci permettant leur différenciation ;
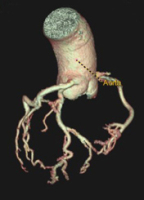
- l’anatomie coronaire des malformations coronaires (ANACOR), des ponts myocardiques, des anastomoses, des fistules coronaires ;
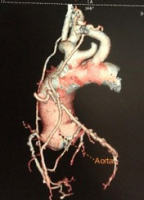
- l’aorte thoracique, dépistage des anévrysmes aortiques thoraciques , visualisation de l’athérome aortique ;
- des calcifications valvulaires aortiques et mitrales ;
- des artères mammaires internes, avant et après pontage coronaire ;
- des stents coronaires et de leur perméabilité.
- Réalisation du score calcique possible, peu irradiante, avec un rôle reconnu pour la stratification du risque cardiaque (rôle pronostique) ...
Ce qui ressort de cette liste non-exhaustive des apports du coroscanner, et du scanner cardiaque en général, est qu’il peut apporter des informations concernant une grande partie des patients que nous suivons en consultation, et notamment une aide considérable en termes de stratification du risque cardiovasculaire en prévention primaire. Sa visualisation de l’anatomie coronaire et le dépistage précoce des plaques d’athérome non-significatives en font un outil d’avenir (2).
Son rôle en prévention primaire
En effet, les recommandations ESC 2016 (3) pour la prévention cardiovasculaire primaire mettent en avant le rôle majeur de l’écho-doppler des TSA et du score calcique. Et à juste titre puisque ces deux examens permettent de reclasser un patient en « haut risque cardiovasculaire », même s’il ne présentait a priori quasiment aucun facteur de risque. Le seuil retenu pour l’écho-doppler des TSA était de 1,5 mm d’épaisseur de plaque pour classer le patient en « très haut risque cardiovasculaire », la catégorie de risque la plus élevée. On pouvait probablement lire entre les lignes qu’une plaque entre 1 mm et 1,5 mm pouvait aussi être prise en compte pour catégoriser le patient en « risque intermédiaire », voire « risque élevé ». La littérature récente semble confirmer le rôle pronostique des plaques carotidiennes et de la valeur de la CRP ultrasensible pour prédire la survenue d’événements cardiovasculaires comme l’infarctus du myocarde ou l’accident vasculaire cérébral (AVC) (4).
En ce qui concerne le score calcique, les recommandations étaient plus discrètes, estimant simplement qu’un score supérieur à 300 UA (unités Agatston) impliquait le du patient dans une catégorie de risque supérieure à celle initiale (3).
Mais le coroscanner ne pourrait-il pas entrer dans ces recommandations, au même titre que l’écho-doppler des TSA ? En effet, la découverte de plaques carotidiennes ≥ 1,5 mm implique la prescription de traitements hypolipémiants avec un objectif de LDLc ambitieux (< 0.70 g/L) pour prévenir la survenue d’événements cardiovasculaires comme l’infarctus du myocarde ou l’AVC (3). Qu’en est-il de la découverte au coroscanner de plaques coronaires plus ou moins calcifiées ?
En sachant qu’une plaque hypodense a un contenu majoritairement cellulaire lipidique et fibreux, est peu calcifiée et potentiellement instable, est-il justifié et éthique de ne pas proposer un traitement hypolipémiant à ces patients porteurs de plaques coronaires sans sténose significative ? Chez les patients ayant des plaques plus ou moins calcifiées, en se basant sur les notions de physiopathologie connues, la prescription d’hypolipémiants peut potentiellement prévenir l’évolution de ces plaques vers une sténose nécessitant une angioplastie, ou encore l’évolution vers une rupture de plaque et donc un infarctus du myocarde. La Grande-Bretagne a pris de l’avance en ce domaine, en utilisant le coroscanner en première ligne de dépistage pour la stratification du risque cardiovasculaire (2).
Il manque dans la littérature des études de large échelle, et surtout sur une longue durée, pour valider cette hypothèse. Devant l’intérêt pronostique probable à traiter en prévention primaire ces patients, n’y aurait-il pas un intérêt à les dépister ?
D’ailleurs, les études criblant les patients porteurs d’hypercholestérolémie familiale montrent la présence de plaques d’athérome calcifiées chez plus de la moitié des patients étudiés, alors que ceux-ci avaient en moyenne moins de 50 ans (5).
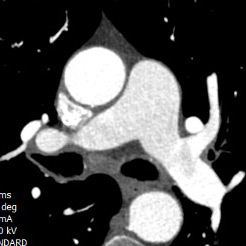
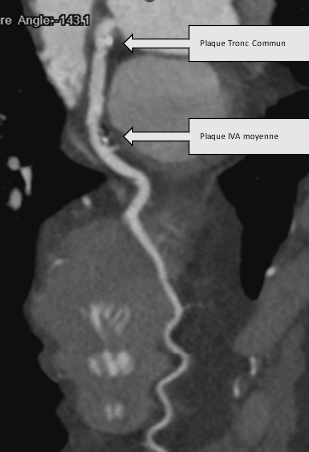
Figure 1 : Exemple d'un coroscanner réalisé en dépistage chez un patient de 50 ans tabagique à 30 PA asymptomatique : présence d’une plaque hétérogène partiellement calcifiée du tronc commun sans sténose significative et d’une plaque hétérogène partiellement calcifiée de l’IVA moyenne.
Son rôle en prévention secondaire
Que le patient ait bénéficié d’une revascularisation par stents ou par pontages, le coroscanner permet de contrôler de manière non-invasive la perméabilité des axes revascularisés par stent ou des artères mammaires internes utilisées pour le pontage (ou encore des artères radiales ou veines saphènes), leur trajet, ainsi que l’anastomose distale de ces pontages.6,7
Bien évidemment, en cas de litige, la coronarographie reste l’examen de référence , mais le criblage par coroscanner peut éviter nombre de coronarographies diagnostiques invasives lorsque les patients sont stables et qu’il s’agit d’un suivi systématique.
Enfin, chez un patient présentant des lésions intermédiaires coronaires, non-revascularisé et traité par hypolipémiants, le coroscanner peut servir à surveiller l’absence d’évolution des sténoses dans le temps.
Le scanner cardiaque (hors coroscanner)
Alors évidemment, puisque nous visualisons les coronaires, nous visualisons aussi le reste des structures cardiaques ou juste adjacentes. Le scanner cardiaque permet d’obtenir de nombreuses informations précieuses dans de multiples indications. Nous pouvons peut retenir les indications suivantes (liste non-exhaustive) dans lesquelles le scanner cardiaque trouve sa place dans l’arsenal diagnostique du clinicien :
- Bilan pré-TAVI avec l’indispensable mesure de l’anneau aortique, de la distance des coronaires au plan de l’anneau... (8) ;
- Bilan pré-fermeture de l’auricule gauche avec les mesures nécessaires au collage de la prothèse et le contrôle de la vacuité de l’auricule gauche (9) ;
- Bilan d’endocardite de recherche d’un abcès de l’anneau notamment (10) ;
- Surveillance de prothèse valvulaire mécanique ou biologique, notamment lorsque l’on suspecte une endocardite ou un thrombus (11) ;
- Bilan pré-opératoire et/ou post- opératoire d’une communication interauriculaire (CIA) , d’une communication interventriculaire (CIV) ou d’autres malformations cardiaques.
D’autres indications sont en cours de validation : la recherche de myocardite, le bilan de cardiopathie ischémique avec recherche de séquelle d’infarctus, la recherche d’hypoperfusion « de premier passage » (possibilité de faire pédaler un patient au scanner contrairement à l’IRM). Cependant, même si ce type de test d’ischémie serait plus physiologique, l’irradiation sera probablement un frein à son utilisation, en comparaison à la richesse des informations apportées par l’IRM, elle, non irradiante.
En conclusion
Le coroscanner et le scanner cardiaque sont actuellement trop peu utilisés en cardiologie, alors qu’ils peuvent apporter une multitude d’informations selon la question posée.
Aucun doute quant à leur avenir dans la prévention primaire, au même titre que l’écho-doppler des TSA pour savoir quel patient nécessite un traitement préventif (hypolipémiant) et de poursuivre avec des explorations cardiovasculaires (test d’ischémie fonctionnel).
Il apparaît aussi difficile en prévention primaire de traiter par hypolipémiants un patient n’ayant aucune plaque au niveau des TSA, une CRP ultrasensible basse et l’absence totale de plaque au coroscanner. Par ailleurs, il semble compliqué de ne pas traiter un patient avec des plaques athéromateuses carotidiennes et/ou coronaires quel que soit son niveau de LDL-cholestérol, et quels que soient ses facteurs de risque cardiovasculaire.
Pour en savoir plus sur le corsocanner
References
- McGraw, S., Carlson, C., Grant, K. & Nijjar, P. S. Feasibility of ultra low-dose coronary computed tomography angiography. Indian Heart J. 70, 443–445 (2018).
- Schmermund, A., Eckert, J., Schmidt, M., Magedanz, A. & Voigtländer, T. Coronary computed tomography angiography: a method coming of age. Clin. Res. Cardiol. Off. J. Ger. Card. Soc. (2018). doi:10.1007/s00392-018-1320-5.
- Piepoli, M. F. et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice : The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur. Heart J. 37, 2315–2381 (2016).
- Eltoft, A. et al. Joint Effect of Carotid Plaque and C-Reactive Protein on First-Ever Ischemic Stroke and Myocardial Infarction? J. Am. Heart Assoc. 7, (2018).
- Pérez de Isla, L. et al. Coronary computed tomographic angiography findings and their therapeutic implications in asymptomatic patients with familial hypercholesterolemia. Lessons from the SAFEHEART study. J. Clin. Lipidol. (2018). doi:10.1016/j.jacl.2018.04.003
- Jungmann, F. et al. Multidetector Computed Tomography Angiography (MD-CTA) of Coronary Artery Bypass Grafts - Update 2017. ROFO. Fortschr. Geb. Rontgenstr. Nuklearmed. 190, 237–249 (2018).
- Roura, G. et al. Long-term prognostic impact of non-invasive follow-up with computed tomography angiography in patients with left main coronary artery stenting. Minerva Cardioangiol. (2018). doi:10.23736/S0026-4725.18.04567-X
- Elattar, M. et al. Automatic aortic root landmark detection in CTA images for preprocedural planning of transcatheter aortic valve implantation. Int. J. Cardiovasc. Imaging 32, 501–511 (2016).
- Saw, J. et al. Comparing Measurements of CT Angiography, TEE, and Fluoroscopy of the Left Atrial Appendage for Percutaneous Closure. J. Cardiovasc. Electrophysiol. 27, 414–422 (2016).
- Sims, J. R. et al. Utility of cardiac computed tomography scanning in the diagnosis and pre-operative evaluation of patients with infective endocarditis. Int. J. Cardiovasc. Imaging 34, 1155–1163 (2018).
- Pizzi, M. N. et al. Improving the Diagnosis of Infective Endocarditis in Prosthetic Valves and Intracardiac Devices With 18F-Fluordeoxyglucose Positron Emission Tomography/Computed Tomography Angiography: Initial Results at an Infective Endocarditis Referral Center. Circulation 132, 1113–1126 (2015).