4 minutes de lecture
Arythmies et syndrome de Tako-Tsubo : existe-t-il une prédisposition génétique ?
Publié le mardi 29 août 2023
Auteure :
Samia Benchekroun
Membre du Collège des Cardiologues en Formation,
Rouen
Relecteur :
Charles Fauvel
Président du Collège des Cardiologues en Formation,
Rouen
En direct de l'ESC Congress 2023
D'après la présentation de Katrin Streckfuss-Boemeke (Wuerzburg, Allemagne) : "Arrhythmia in Takotsubo"
Les messages clés
- Un modèle fiable de cardiomyocytes atriaux atteints de syndrome de Tako-Tsubo in vitro permet d’étudier le phénotype rythmique de ces cellules.
- Cette étude a mis en évidence une prédisposition génétique, avec des mutations spécifiques sur deux gènes : CASQ2 et AHNAK.
- Une nouvelle stratégie thérapeutique semble prometteuse via des activateurs de phosphodiestérases (MRL2).
Introduction
Le syndrome de Tako-Tsubo (TTS) est bien connu et décrit, avec atteinte ventriculaire gauche caractéristique. Il est maintenant bien démontré que cette atteinte n’est pas isolée, et qu’une atteinte atriale gauche y est généralement associée, ayant pour conséquence la survenue de fibrillation atriale dans 18 % des cas.
L’équipe de K.Streckfuss-Bomeke avait antérieurement élaboré un modèle in-vitro de cardiomyocytes ventriculaires atteints de Tako-Tsubo, et avait prouvé leur sensibilité accrue aux catécholamines, et la baisse de la désensibilisation aux catécholamines. Par ailleurs, ils avaient identifié plusieurs variants génétiques présents dans 80 % des cellules sur les gènes CASQ2 et AHNAK.
Ils ont aujourd’hui réutilisé cette technique afin d’étudier l’atteinte cellulaire atriale du Tako-Tsubo, dans le but d’essayer de comprendre la genèse des troubles du rythme atriaux et leur substrat génétique.
Il avait été antérieurement démontré que la fibrillation atriale était liée à une activité décroissante des PDE4 (phosphodiestérase 4), enzyme qui a pour rôle de dégrader l’AMPc dans la cascade de la voie béta-adrénergique.
Principe de l'étude, méthodologie et résultats
L’étude a essayé de répondre à 3 questions :
- Les événements rythmiques au sein des cellules iPSC-CM auriculaires contribuent-ils au développement du TTS ?
- Existe-t-il une prédisposition génétique aux événements rythmiques atriaux dans le TTS ?
- Peut-on proposer une stratégie thérapeutique spécifique dans ce cas ?
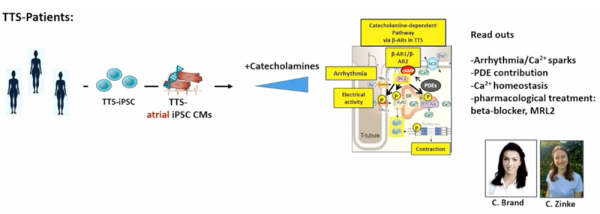
À partir d’un registre de patients atteints de syndrome de Tako-Tsubo, le Tako-Tsubo Registry (à Gottingen et Zurich ; composé uniquement de femmes de plus de 60 ans, avec atteinte ETT typique), des cellules IPS spécifiques aux patients à partir de leurs cellules somatiques ont pu être créées in vitro, ce qui a permis de générer des cardiomyocytes atriaux atteints de syndrome de Tako-Tsubo in vitro (Figure 1).
Figure 1 : Genèse des cardiomyocytes atriaux « Tako-Tsubo » via traitement par des catécholamines in vitro.
Un intérêt particulier a alors été porté à l’homéostasie calcique et à la fréquence cardiaque cellulaire.
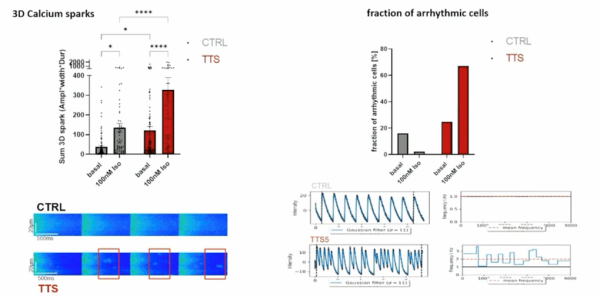
Il a pu être démontré qu’à l’état basal, puis sous ISOPRENALINE (= stress adrénergique), les TTS-CM (Cardiomyocytes auriculaires Tako-Tsubo) présentent des troubles importants de l’homéostasie calcique, s’accompagnant fréquemment d’arythmie atriale (Figure 2).
Figure 2 : les TTS-CM (Cardiomyocytes auriculaires Tako Tsubo) présentent une fuite diastolique accrue de calcium et une proportion élevée de cellules en arythmie.
Partant du postulat que la fibrillation atriale était liée à une activité en PDE décroissante, des inhibiteurs spécifiques de PDE (qui avaient au final le même effet que les catécholamines, soit un effet inotrope positif par augmentation de l’AMPc) ont été utilisés, et les TTS-CM ont été étudiés après traitement par ISOPRENALINE et par inhibiteur de PDE4 (Rolipram).
Cette étude a ainsi montré que l’activité de cette TTS-CM présentait une activité des PDE abaissée en comparaison aux cellules contrôles, avec une amplitude de la transitoire calcique abaissée, et enfin que le temps de relaxation de ces cellules était ralenti de 80 %
Cela suggère que la phosphodiestérase 4 joue un rôle dans la genèse des arythmies atriales dans le contexte du syndrome de TTS.
Le génotypage des patients du registre a montré qu’ils avaient tous une mutation sur le gène codant pour la protéine AHNAK, habituellement exprimée dans le cerveau et le cœur, et qui a pour rôle de réguler l’activité des canaux calciques cardiaques. Ces patients (comparés à des contrôles sans TTS) avaient des taux de calcium intra-cellulaire plus importants, et un taux d’expression de la protéine AHNAK plus bas.
Après génération de lignées isogéniques, avec thérapies géniques ciblées, les auteurs ont montré que la mutation du gène AHNAK semble être responsable de l’hypersignal calcique, et de l’augmentation importante du nombre de cellules à fréquence cardiaque irrégulière ; et ceci étant associé à une diminution de l’activité de la PDE4.
Enfin, une potentielle application clinique a été recherchée. Les bêtabloquants étant utilisés en pratique clinique dans le TTS, leur activité a été comparée à un traitement activateur des PDE (MRL2). Les résultats ont montré que le Métoprolol est capable de diminuer l’hypersignal calcique et les évènements rythmiques de 50 %. Au contraire, l’utilisation d’activateur de PDE montrait une restauration de l’activité de PDE4, de la transitoire calcique, une diminution des fuites calciques et, in fine, une diminution du nombre de cellules en arythmie.
Conclusion
Cette étude s’intéressant à un modèle in-vitro de cardiomyocytes atriaux dans un contexte de syndrome de Tako-Tsubo, il a été démontré que :
- Ce modèle est fiable pour étudier le phénotype d’arythmies de ces patients
- Ces cellules ont une activité PDE4 diminuée, ce qui entraine un nombre élevé d’arythmies, une altération de l’homéostasie calcique et une sensibilité accrue aux catécholamines
- Il a aussi été mis en évidence une prédisposition génétique au sein des deux gènes suivants, qui prédisposent aux arythmies atriales dans ce contexte :
- CASQ2, qui intervient dans l’homéostasie calcique à l’état basal au niveau du réticulum sarcoplasmique
- AHNAK, qui explique la fuite calcique induite par un état de stress adrénergique, les arythmies et la diminution de l’activité des phosphodiestérases dans les cellules Tako-Tsubo.
Une nouvelle stratégie thérapeutique innovante a même été proposée via des activateurs spécifiques de phosphodiestérases (MRL2).
Pour en savoir plus, consultez les LBS, LBT et hotlines complètes, en langue anglaise, présentées lors de l'ESC 2023 :
Toute l'actualité de l'ESC 2023
Cette couverture de congrès vous est proposée grâce au soutien institutionnel de
l'alliance Boehringer Ingelheim - Lilly, de CSL Vifor et de Sanofi
Ce compte rendu d'étude ne reflète pas l'opinion de Cardio-online ou de la SFC, et n'engage pas leur responsabilité.
|